Среди факторов, влияющих на летальность пациентов, получающих заместительную почечную терапию (ЗПТ) (демографические, основное заболевание и сопутствующие болезни, воспаление, питательный статус и др.), анемия и нарушения минерально-костного обмена с гиперпаратиреозом стоят на особом месте, поскольку относятся к частым и потенциально модифицируемым осложнениям хронической болезни почек (ХБП). Несмотря на разные клинические проявления, звенья патогенеза, методы лечения, у этих осложнений много общего.
С одной стороны, их объединяет высокий вклад в морбидность и летальность, что делает их самостоятельными факторами риска смерти у больных с ХБП. С другой — лечение анемии и нарушений минерально-костного обмена связано с применением дорогостоящих препаратов (стимуляторы эритропоэза, аналоги витамина D, не содержащие кальций фосфат-биндеры, кальцимиметики), которые могут потребовать львиную долю всего бюджета, выделяемого на медикаменты для пациентов, получающих ЗПТ. Еще одной проблемой в отношении этих осложнений выступает интерпретация существующей доказательной базы о пользе коррекции и целевых показателях лечения.
Так, например, анемия как осложнение и фактор риска начинает проявлять себя еще на ранних стадиях ХБП, нарастая по мере ее прогрессии [1, 2, 3]. Доказано, что анемия ассоциируется с прогрессией ХБП (снижение гематокрита ниже 40% для мужчин и 35% для женщин повышает риск развития терминальной стадии ХПН [4]), сопряжена с развитием сердечно-сосудистых осложнений как на начальных стадиях ХБП [5], так и при развитии терминальной стадии (снижение гемоглобина на 10 г/л приводит к увеличению частоты дилятации левого желудочка (ЛЖ) на 46% и развития сердечной недостаточности (СН) на 28% [6]), а также возникает у пациентов после трансплантации почки. Если просмотреть данные национальных регистров таких разных в популяционном отношении стран, как Япония и США, то они будут свидетельствовать о взаимосвязи риска смерти и снижения гемоглобина ниже 100–110 г/л у пациентов, получающих ЗПТ.
Эти и другие данные обосновывают необходимость коррекции анемии, что представлено в различных руководствах, использующих методы доказательной медицины. Однако дальнейшая оценка пользы коррекции анемии встречает существенные трудности, что особенно заметно при сравнении данных рандомизированных и обсервационных исследований. Трудности эти обусловлены тем, что, несмотря на взаимосвязь анемии с летальностью, уровнем госпитализации, качеством жизни больных, получающих ЗПТ, ее коррекция не всегда позволяет изменить эти показатели (так называемые истинные критерии результативности медицинских вмешательств) в лучшую сторону, что во многом связано с недостаточным количеством таких исследований [7]. Так, данные рандомизированных исследований, с одной стороны, свидетельствуют об улучшении качества жизни у больных при повышении гемоглобина, с другой — фактически оказываются несостоятельными при попытках доказать пользу в отношении выживаемости и уменьшения морбидности, и в большинстве случаев они свидетельствуют о нежелательности подъема уровня гемоглобина выше 120 г/л [8–11].
В то же время обсервационные исследования указывают на лучшую выживаемость при повышении гемоглобина выше 120–130 г/л [12–15], однако последние не позволяют ответить на вопрос о том, действительно ли прирост гемоглобина, связанный с назначением стимуляторов эритропоэза, обуславливает этот эффект.
Те же тенденции в отношении летальности, обоснования необходимости терапии и оценки ее результативности можно отметить и для нарушений фосфорно-кальциевого обмена. На них впервые в 1998 г. обратил внимание Block G. A. [16], когда, оценив ретроспективные данные 6407 гемодиализных пациентов, он выявил существенное нарастание риска смерти при гиперфосфатемии и высоком фосфорно-кальциевом продукте. Это в конечном итоге находит свое подтверждение у других исследователей [17–19] и служит началом коренного пересмотра тактики лечения вторичного гиперпаратиреоза, выработки целевых показателей фосфорно-кальциевого обмена [20, 21].
Однако и в данном случае мы встречаем существенные сложности с поиском доказательной базы эффективности вмешательств. Прежде всего, можно отметить недостаточное количество рандомизированных исследований, в то время как обсервационные могут давать абсолютно противоположные посылы. Показательным в этом отношении является интерпретация приведенных ниже двух исследований по оценке пользы витамина D и его аналогов. Первое, включавшее 6 латиноамериканских стран (CORES) и длившееся 16 месяцев, показало значительное снижение общей кардиоваскулярной, инфекционной и онкологической летальности у 7203 пациентов, получавших внутрь витамин D, по сравнению с 8801 больным, не получавшим такой терапии. И эти преимущества сохранялись при дальнейшей стратификации по 36 параметрам (в т. ч. кальций, фосфор, паратиреоидный гормон (ПТГ)) из 37. В конечном итоге было показано снижение риска смерти на 45% (HR 0,55; 95% CI 0,49–0,63) [22]. А второе исследование, проводимое в рамках DOPPS (1996–2007 гг.) и включавшее 38 066 человек из 12 стран, в конечном итоге, при точном учете коморбидных факторов (в т. ч. лабораторных показателей), не выявило преимуществ в отношении летальности при терапии витамином D (RR = 0,98 (0,93–1,02)) [23].
Осложняет оценку эффективности различных вмешательств при минерально-костных нарушениях, обусловленных ХБП, и тот факт, что для лечения этих осложнений используется несколько групп препаратов, направленных на разные звенья патогенеза нарушений фосфорно-кальциевого обмена. Например, фосфат-биндеры, витамин D и его аналоги, кальцимиметики. Эти препараты могут иметь разнонаправленное действие, что усложняет последующую оценку и требует разработки новых алгоритмов их применения, как это было сделано в исследовании OPTIMA [24]. В этом исследовании удалось достигнуть одновременного достижения целевых значений по уровню фосфорно-кальциевого произведения и ПТГ у 59% больных, что на сегодняшний день значительно опережает результаты реальной клинической практики, которые, в частности, приводятся в обсервационном исследовании ECHO [25].
В конечном итоге на сегодняшний день мы можем констатировать нередкое расхождение в результатах клинических исследований и реальной клинической практике лечения минерально-костных нарушений при ХБП. И эти расхождения нередко свидетельствуют о лучших исходах в обычной практике при достижении общепринятых целевых показателей, что мы не всегда видим в рандомизированных исследованиях. Возможно, это связано не только с фактом коррекции тех или иных нарушений или тем, что эти пациенты имеют лучший коморбидный статус, но и тем фактом, что достижение целевых показателей терапии свидетельствует о более высоком качестве ведения больных, что подразумевает более строгое следование существующим стандартам в области ЗПТ.
Одними из первых национальных рекомендаций, разработанных под эгидой Российского диализного общества (РДО), появились рекомендации по диагностике и лечению анемии, а в настоящий момент обсуждается принятие рекомендаций по коррекции минерально-костных нарушений у больных с ХБП. При отсутствии утвержденных административными органами стандартов, соблюдение этих рекомендаций, достижение предлагаемых в них целевых показателей — по уровню гемоглобина, показателям фосфорно-кальциевого обмена должно свидетельствовать об определенном качестве лечения больных, получающих ЗПТ.
Тем не менее, уровень соблюдения рекомендаций остается невысоким. Это видно на примере ежегодных отчетов РДО [26]. Вероятно, одной из главных причин несоблюдения рекомендаций в РФ может быть недостаточное финансирование диагностических и лечебных мероприятий. Вместе с тем существует и проблема незнания или неприятия тех или иных положений. Последняя проблема существует не только в РФ, где следуют целевым уровням гемоглобина, предлагаемым в национальных рекомендациях в 90% отделений, так и в других странах. Например, по данным исследования, проведенного в Италии (2008 г.), политика отделений в отношении лечения анемии и минерально-костных нарушений соответствовала международным рекомендациям только в 40–50% случаев [27].
Несоблюдение рекомендаций напрямую не свидетельствует о низком качестве лечения больных, но требует анализа реальной клинической практики коррекции анемии и минерально-костных нарушений. Такая работа на регулярной основе проводится как на межнациональном уровне (например, исследования DOPPS), так и в отдельных странах. Это в конечном итоге выступает одним из важнейших путей повышения качества лечения больных, получающих ЗПТ, что может использоваться для системной оценки пользы и дальнейшей коррекции национальных рекомендаций и стандартов. Исследований такого рода в РФ недостаточно.
Цель исследования
Оценить распространенность анемии и минерально-костных нарушений, оценить практику их лечения у пациентов с ХБП, получающих гемодиализ.
Материал и методы исследования
Первоначально исследование проводилось на базе 11 отделений диализа Санкт-Петербурга и Екатеринбурга, однако в дальнейший анализ были включены пациенты 5 отделений, в которых охват данных составил более 80% всех больных, наблюдавших в них. Данные представлялись врачами отделения диализа посредством введения в единую базу данных. С целью защиты личной информации персональные данные пациентов в базу не вносились. В исследование включено 385 больных, получавших бикарбонатный гемодиализ и наблюдавшихся за период с 2008 по 2009 гг., из них 263 пациента наблюдались в динамике от 3 до 6 месяцев. Среди обследованных 210 — мужчины и 175 — женщины. Возраст пациентов колебался от 18 до 87 лет (54,6 ± 13,58). Предоставленная доза диализа по eKt/V составила 1,22 ± 0,241 (0,2–1,9). Среди заболеваний, послуживших причиной развития терминальной ХПН (тХПН) (табл. 1), наиболее часто был указан хронический гломерулонефрит — у 201 пациента (52,2%), в большинстве случаев этот диагноз не был подтвержден биопсией. Причиной тХПН у 60 пациентов (15,6%) был интерстициальный нефрит. Реже в основе тХПН лежали такие заболевания, как поликистоз почек (ПК) — 41 пациент (10,6%), сахарный диабет — 37 пациентов (9,6%), артериальная гипертензия — 24 пациента (6,2%).
Среди сопутствующих заболеваний лидировала ишемическая болезнь сердца, которая выявлялась у 42,9% больных (табл. 2).
Оценивались показатели гемоглобина (доля пациентов, достигших целевого уровня гемоглобина, равного 110 г/л, индивидуальные колебания гемоглобина), концентрация ферритина (как показатель запасов железа в организме), показатели фосфорно-кальциевого обмена: кальций и фосфор сыворотки, фосфорно-кальциевое произведение, уровень ПТГ. Целевые значения показателей фосфорно-кальциевого обмена определялись согласно рекомендациям Национального почечного фонда США (NKF-DOQI, 2003).
Исследовались частота назначения и дозы стимуляторов эритропоэза, частота назначения препаратов, влияющих на фосфорно-кальциевый обмен и вторичный гиперпаратиреоз.
Количественные показатели представлены в виде средних значений и стандартного отклонения, для их сравнения использовался t-критерий Стьюдента.
Результаты исследования
Коррекция анемии и уровень гемоглобина
Средний уровень гемоглобина был равен 106,1 ± 14,56 г/л. Гемоглобин ниже целевых значений (< 110 г/л) определялся у 58,7% пациентов (224 чел.), у 37,4% больных (143 чел.) гемоглобин был в пределах от 110 до 130 г/г и у 3,9% (15 чел.) больше 130 г/л (табл. 3).
Между центрами были отмечены существенные колебания как по среднему гемоглобину (колебания от 99,7 до 112,9 г/л), так и по доле больных, имевших целевой уровень гемоглобина.
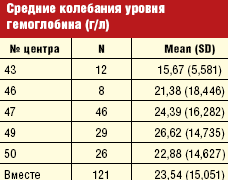
Динамическая оценка гемоглобина была доступна у 263 пациентов. Достоверной разницы в средних значениях гемоглобина на начало исследования (107,7 ± 15,8 г/л) и конец исследования (105,3 ± 17,15 г/л) не было выявлено. Однако индивидуальные колебания гемоглобина имели значительную вариабельность. С целью их более детальной оценки была выбрана группа больных с гемоглобином на момент начала исследования в пределах целевых значений (≥ 110 г/л). За время исследования амплитуда колебаний гемоглобина в этой группе составила в среднем 23,5 ± 15,05 г/л (табл. 4). При этом данная величина от центра к центру имела существенные отличия от минимального 15,7 ± 5,58 г/л до максимального значения, равного 26,6 ± 14,74 г/л.
Показатели обмена железа
В качестве показателя запасов железа в организме оценивался уровень ферритина, что было доступно у 230 пациентов (59,7%), при этом обращал внимание тот факт, что в некоторых центрах, несмотря на относительно частое назначение препаратов железа (до 87% больных), данные об уровне ферритина были практически недоступны. В изученной группе уровень ферритина колебался от 20 до 1108 нг/мл, составив в среднем 278,8 ± 243,98. Средние значения ферритина в разных центрах имели значимые отличия от 185,3 до 396,1 нг/мл (табл. 5).
Частота выявления абсолютного дефицита железа (ферритин < 100 нг/мл) по разным центрам колебалась от 22% до 33%. Доля больных с абсолютным дефицитом железа в изученной группе составила 26,2% (61 чел.).
Препараты железа были назначены 246 пациентам (63,9%). Частота назначения препаратов железа в разных центрах колебалась от 44% до 87% (табл. 6).
Стимуляторы эритропоэза
Среди пациентов, включенных в исследование, постоянную терапию стимуляторами эритропоэза получали 328 чел. (85,2%). Наиболее часто назначался эпоэтин альфа (57,9%), доля пациентов, получавших пролонгированные формы (дарбэпоэтин альфа и пегилированный эпоэтин бета), составила 15,2% (табл. 7). Как видно из таблицы, средние недельные дозы препаратов находились в пределах, рекомендованных производителем. Среди обследованных больных только у одного пациента можно было говорить о резистентности к терапии эпоэтином, т. е. им была достигнута доза выше 300 МЕ/кг/нед.
Разницы в уровне гемоглобина среди пациентов, получавшие разные стимуляторы эритропоэза, не получено.
Таким образом, средний уровень гемоглобина в изученной популяции больных был равен 106,1 ± 14,56 г/л, доля больных с целевыми значениями гемоглобина составляет менее половины — 41,4%. За время наблюдения от 3 до 6 месяцев среднее значение амплитуды колебаний гемоглобина среди больных с целевым уровнем гемоглобина было равно 23,5 ± 15,05 г/л.
Доля больных, получающих стимуляторы эритропоэза, составила 85,2%, основными стимуляторами эритропоэза являлись препараты короткого действия (84,8%), их средние дозы были равны 5660 МЕ для эпоэтина альфа и 6291 МЕ для эпоэтина бета, разницы в уровне гемоглобина в зависимости от применяемого стимулятора эритропоэза не выявлено. Средние дозы используемых стимуляторов находятся в пределах, рекомендованных производителем. Несмотря на значительную долю больных, не достигших целевого уровня гемоглобина, был выявлен всего один пациент, получавший дозу рекомбинантного человеческого эритропоэтина (рчЭПО), свидетельствующую о резистентности к терапии, т. е. выше 300 МЕ/кг/нед.
Обследование на предмет запасов железа проведено у 59,7%, средний уровень ферритина был равен 278,8 ± 243,98 нг/мл. Доля пациентов с признаками абсолютного дефицита составила 26,1% (60 чел.). Частота назначения парэнтеральных препаратов железа была равна 63,9% (44–87%).
Коррекция минерально-костных нарушений и вторичного гиперпаратиреоза
Изучены следующие показатели нарушений минерально-костного обмена — общий кальций, фосфор и ПТГ. Целевые значения определялись согласно рекомендациям национального почечного фонда США (NKF-DOQI, 2003). В обследованной группе больных с целью коррекции нарушений минерально-костного обмена 214 чел. (55,6%) получали препараты витамина D, 345 (89,6%) — фосфатсвязывающие препараты (практически всем, за исключением двух пациентов, были назначены кальцийсодержащие фосфат-биндеры).
Средние значения изученных показателей представлены в табл. 8.

При оценке распределения больных в зависимости от достижения целевых показателей минерально-костного обмена было выявлено, что по уровню кальция, фосфора и ПТГ они были достигнуты у 50,6%, 38,4% и 22,7% больных соответственно (табл. 9). Обращает внимание и то, что среди больных, получавших витамин D, у 68 (33,8%) определялась гиперкальциемия, у 51 чел. (34,5%) ПТГ был ниже целевых значений, а у 97 чел. (48,0%) была гиперфосфатемия.
Таким образом, в обследованной группе больных целевые значения по уровню кальция были у 179 чел. (50,6%), по фосфору у 136 чел. (38,4%) и ПТГ у 53 чел. (22,7%). Основными препаратами, которые используются для коррекции нарушений минерального обмена, являются кальцийсодержащие фосфатсвязывающие препараты и препараты витамина D.
Выявление у больных, получавших витамин D, гиперкальциемии в 33,8% случаев, гиперфосфатемии в 48,0% случаев и снижения ПТГ ниже целевых значений в 34,5% случаев свидетельствует о нерациональном его использовании.
Обсуждение
Среди осложнений, развивающихся у больных ХБП, одни из самых частых — анемия и нарушения минерально-костного обмена. Известна взаимосвязь этих осложнений с морбидностью и летальностью. Поэтому вопросам их коррекции всегда уделяется много внимания. Не случайно одними из первых отечественных рекомендаций у пациентов с ХБП появились рекомендации по лечению анемии (2006 г.), а в настоящее время обсуждаются рекомендации по лечению минерально-костных нарушений. Соблюдение этих рекомендаций должно свидетельствовать о качестве лечения больных, получающих ЗПТ.
Сегодня в РФ при переходе финансирования ЗПТ в систему обязательного медицинского страхования вопрос оценки ее качества поднимается на новый уровень, поскольку следует ожидать в недалеком будущем экспертизы результативности медицинских вмешательств у больных с тХПН. Критерии этой результативности нам хорошо известны, они отработаны в упомянутых выше рекомендациях. Насколько мы готовы следовать этим рекомендациям, вопрос открытый. Ведь даже в развитых странах, как показывает исследование DOPPS, внедрение международных рекомендаций остается субоптимальным, что видно на примере коррекции артериальной гипертензии, анемии и минерально-костных нарушений [28–30].
Анемия — одно из самых частых осложнений ХБП. Ее развитие тесно связано со снижением функции почек, поэтому неудивительно, что частота анемии у пациентов с ХБП превосходит общепопуляционные показатели [31]. Несмотря на то, что статистически достоверное нарастание частоты и тяжести анемии у больных ХБП начинается на ранних стадиях ХБП [32, 33], основным патогенетическим фактором ее развития считается дефицит эндогенного эритропоэтина, который развивается практически у всех пациентов при снижении скорости клубочковой фильтрации (СКФ) 30 мл/мин и ниже. Данные об истинной распространенности и тяжести анемии у больных, получающих ЗПТ, на сегодняшний день практически недоступны, поскольку большинство из них получает стимуляторы эритропоэза. Более точно можно ответить на вопрос о доле больных, нуждающихся в коррекции анемии, что по разным данным составляет 85–90%. Но в этом вопросе существуют разночтения, которые связаны с определением показаний для активного лечения анемии.
Современная история лечения нефрогенной анемии тесно связана с внедрением в клиническую практику эпоэтинов, опыт применения которых насчитывает более 20 лет. По данным клинических исследований назначение этих препаратов позволяет достигнуть целевых уровней гемоглобина у подавляющего большинства больных. Но, несмотря на столь солидный «возраст» и высокую эффективность эпоэтинов, до настоящего времени практические рекомендации лечения нефрогенной анемии, которые в значительной мере основаны на консенсусе, не устоялись и подвергаются довольно частому пересмотру. В частности, проявлением такой неустойчивости является неоднородность мнений в отношении целевых уровней гемоглобина между национальными клиническими руководствами, рекомендациями административных органов и производителей препаратов (табл. 10), а также частным мнением отдельных нефрологов.
В настоящей работе мы провели сравнительную оценку частоты достижения целевых показателей гемоглобина в шести центрах Санкт-Петербурга и Екатеринбурга. За целевой уровень был принят уровень гемоглобина ≥ 110 г/л, что соответствует Российским национальным рекомендациям и позволяет провести сравнительный анализ с имеющимися данными литературы. Средний уровень гемоглобина для всех больных составил 106,1 ± 14,56, из них целевой уровень гемоглобина ≥ 110 г/л достигнут у 41% больных. Если сравнивать эти показатели с данными популяции диализных больных Санкт-Петербурга в 2004 г. [34], можно отметить определенный прогресс. Так, средний уровень гемоглобина у превалентных пациентов (n = 669), получавших гемодиализ в Санкт-Петербурге в 2004 г., был равен 96,2 г/л, а доля больных с гемоглобином ≥ 110 г/л составляла 21,3%.
При сравнении наших данных с исследованиями анемии, проводившимися в европейских странах, можно констатировать то, что наши показатели близки к тем, что наблюдались в странах Западной Европы в 1998 г. (EuroDOPPS), и значительно ниже тех, что наблюдаются после 2000 г. (EuroDOPPS, ESAM-2003) [35, 36]. Так, если по результатам исследования EuroDOPPS, включавшего 2590 больных, получавших гемодиализ в пяти европейских странах, в 1998 г. средний уровень гемоглобина составил 108 г/л и процент больных с гемоглобином больше 110 г/л — 44%, то в 2000 г. эти цифры были 111 г/л и 53% соответственно. А в исследовании ESAM 2003 г. (8100 диализных больных из 12 стран) средний уровень гемоглобина был уже равен 115 г/л и доля больных с гемоглобином ≥ 110 г/л у больных, получавших гемодиализ, составляла 64,7%.
Необходимо отметить и то, что полученные данные о частоте достижения целевого уровня гемоглобина отличаются и от средних общероссийских показателей, доступных из анализа уже упоминавшегося выше регистра РДО [26], где доля больных с целевым уровнем гемоглобина в 2007 г. составила половину больных.
В нашей работе была проведена оценка индивидуальных колебаний гемоглобина у пациентов, имевших целевой уровень гемоглобина на момент начала исследования (≥ 110 г/л). В последние годы индивидуальным колебаниям гемоглобина придается особое значение [37, 38]. Так, в работе S. Fishbane было показано, что 90% пациентов, получающих гемодиализ в течение года, имеют колебания уровня гемоглобина с амплитудой более 15 г/л, при этом средняя амплитуда составляет 25 г/л, а среднее количество таких циклов равно 3,1 года на одного пациента. Причинами этих колебаний могут быть узкий целевой уровень, резкие изменения дозы рчЭПО, интермиттирующее назначение препаратов железа, острые заболевания [39].
С целью оценки вариабельности уровня гемоглобина была выбрана группа больных с гемоглобином на момент начала исследования больше 110 г/л. Средние колебания гемоглобина за время исследования в этой группе составили 23,5 ± 15,05 г/л, что фактически соответствует приведенным выше данным литературы. Однако величина средней амплитуды колебаний уровня гемоглобина от центра к центру имела существенные отличия от минимального 15,7 ± 5,58 г/л до максимального значения, равного 26,6 ± 14,74 г/л, что говорит о том, что вероятно существуют модифицированные факторы, которые могут влиять на уменьшение этих колебаний.
Одним из важнейших условий лечения нефрогенной анемии выступает поддержание оптимальных запасов железа [40]. В связи с хронической кровопотерей, превышающей возможности восполнения запасов железа путем перорального приема препаратов железа, единственным способом восполнения его дефицита признается парэнтеральное введение железа. Частота назначения препаратов железа в разных центрах колебалась от 44% до 87%, что практически мало отличается от данных EuroDOPPS в 2000 г., в этом исследовании частота назначения колебалась от 43% (Италия) до 71% (Германия), однако она все же ниже, чем аналогичные показатели, представленные в отчете Российского регистра заместительной почечной терапии.
Эффективность коррекции дефицита железа определяется по показателям запаса железа в организме. Одним из наиболее часто используемых в клинике показателей запаса железа в организме выступает ферритин сыворотки. Если в отношении оптимальных и максимально допустимых значений ферритина еще существуют определенные споры, то уровень 100 нг/мл у пациентов, получающих ЗПТ, признается всеми как показатель абсолютного дефицита железа. Ферритин сыворотки исследовался только у 59,7% больных. Доля больных с абсолютным дефицитом железа в изученной группе была высока и составила 26,2%, доходя в некоторых центрах до 33%. Эти показатели практически не изменились при сравнении с данными исследования диализных больных в Санкт-Петербурге в 2004 г. и уступают аналогичным показателям исследования ESAM 2003 г., по данным которого абсолютный дефицит выявлялся у 10,3% больных.
Доля больных, получающих стимуляторы эритропоэза, составила 85,2%, основными стимуляторами эритропоэза являлись препараты короткого действия (84,8%), их средняя дозировка была равна 5660 МЕ для эпоэтина альфа и 6291 МЕ для эпоэтина бета, разницы в уровне гемоглобина в зависимости от применяемого стимулятора эритропоэза не выявлено. Средние дозы используемых стимуляторов находятся в пределах, рекомендованных производителем. Однако они ниже средних доз, которые используются в странах Западной Европы, например, по данным ESAM-2003 средние дозы были равны 8396 ± 6382 МЕ/нед. Несмотря на значительную долю больных, не достигших целевого уровня гемоглобина, был выявлен всего один пациент, получавший дозу рчЭПО выше 300 МЕ/кг/нед, которая свидетельствовала о резистентности к терапии.
Таким образом, результаты исследования лечения анемии, у пациентов, получающих гемодиализ, свидетельствуют о неадекватном ее контроле, т. к. целевые значения уровня гемоглобина, рекомендованного национальными рекомендациями, были зафиксированы лишь у 41% больных. Среди выявленных причин, которые способствуют низкой результативности, следует отметить неадекватное восполнение запасов железа, т. к. доля больных с абсолютным дефицитом железа была 26%. Несмотря на невысокий процент достижения целевого уровня гемоглобина, пациентов с формальными признаками резистентности к терапии эпоэтинами практически нет, что свидетельствует еще и о том, что дозы стимуляторов эритропоэза также неадекватны (низкие).
Параллельно исследованию практики лечения анемии в данной работе была выполнена оценка результатов лечения минерально-костных нарушений. Особый интерес к этой проблеме объясняется тем, что эволюция подходов к ней за последние 20 лет претерпела значительные изменения — от проблем аллюминоза и ренальной остеодистрофии к дефициту витамина D и вторичному гиперпаратиреозу и, наконец, к констатации того, что одним из главных факторов риска смерти являются нарушения фосфорно-кальциевого обмена и кальцификация сосудов. Несомненными этапами этой эволюции явились появление и переосмысление терапевтических подходов — от совершенствования технологии заместительной почечной терапии (централизованные водоочистки с обратным осмосом, внедрение гемодиафильтрации, ежедневный диализ, снижение кальция в диализате) до медикаментозных рекомендаций (ограничения кальцийсодержащих фосфат-биндеров, препаратов витамина D и назначения кальцимиметиков).
Однако, несмотря на столь существенные изменения в отношении коррекции минерально-костных нарушений при ХБП, практические результаты достижения целевых значений выглядят неудовлетворительно. Об этом же свидетельствуют и результаты нашего исследования. Так, целевые значения по уровню кальция были отмечены у 50,6%, фосфора у 38,4% и ПТГ у 22,7%. Эти результаты мало отличаются от результатов других стран [41], и это с учетом отсутствия возможности назначения не содержащих кальций фосфат-биндеров, современных аналогов витамина D, кальцимиметиков.
Основными препаратами, которые использовались для коррекции нарушений минерального обмена, являются кальцийсодержащие фосфатсвязывающие препараты (89,6% больных) и препараты витамина D (55,6% больных). В настоящей работе сложно оценить адекватность назначения этих препаратов, мы не проводили более глубокий анализ, связанный с диализатом, режимом диализа, соблюдением диеты и т. п. Однако, как нам представляется, назначение витамина D было нерациональным, об этом свидетельствует то, что частота противопоказаний (показаний к его отмене или уменьшению дозы) достигала 48%. Так, у 48,0% больных, получающих витамин D, отмечалась гиперфосфатемия, у 33,8% — гиперкальциемия, у 34,5% ПТГ был ниже целевых значений, последнее является прямым противопоказанием к назначению витамина D и предрасполагает к развитию адинамической костной болезни.
Таким образом, мы попытались с формализованных позиций существующих клинических рекомендаций оценить терапию анемии и минерально-костных нарушений у пациентов, получающих гемодиализ. Необходимо отметить и то, что существующие рекомендации не безупречны, но в наших силах их изменить в случае появления новых критических данных, как это происходит, в частности, на примере разработки рекомендаций по коррекции анемии. Тем не менее, их соблюдение может выступать еще и показателем общего качества ЗПТ.
Проведенный анализ свидетельствует о неадекватной коррекции анемии, о чем говорит невысокий процент достижения целевого уровня гемоглобина, что может быть исправлено с учетом опыта других стран и центров. Вероятно, в основе этого лежит недостаточная коррекция дефицита железа и относительно низкие дозы эпоэтинов.
Коррекция минерально-костных нарушений также далека от целевых уровней, обозначенных в рекомендациях, однако сравнительный анализ не выявляет существенных отличий от большинства других центров, что подтверждает объективные сложности, связанные с недостаточным терапевтическим арсеналом. Тем не менее, обращает внимание частое назначение витамина D, даже при наличии противопоказаний, что говорит о его нерациональном использовании.
Данное исследование поддержано грантом компании Amgen.
Литература
-
Kazmi W. H., Kausz A. T., Khan S. et al. Anemia: An Early Complication of Chronic Renal Insufficiency // Am J Kidney Dis. 2001, 38: 803–812.
-
Hsu C. Y., McCulloch C. E., Curhan G. C. Epidemiology of anemia associated with chronic renal insufficiency among adults in the United States: results from the third national health and nutrition examination survey // J Am Soc Nephrol. 2002, 13: 504–510.
-
Ряснянский В. Ю., Шостка Г. Д, Команденко М. С., Конакова И. Н, Аниконова Л. И., Дору-Товт В. П. Частота и тяжесть анемии у пациентов на додиализных стадиях ХБП, наблюдающихся в городском нефрологическом центре Санкт-Петербурга // Анемия. Журн. рабочей группы по анемии. 2007; 1: 15–21.
-
Kunitoshi Iseki, Yoshiharu Ikemiya, Chiho Iseki, Shuichi Takishita. Haematocrit and the risk of developing end-stage renal disease // Nephrol Dial Transplant. 2003; 18: 899–905.
-
Levin A., Thompson C. R., Ethier J. et al. Left ventricular mass index in early renal disease: impact of decline in hemoglobin // Am J Kidney Dis. 1999; 34: 125–134.
-
Foley R. N., Pafrey P. S., Harnett J. D., Kent G. M., Murray D. C., Barre R. N. The impact of anemia on cardiomyopathy, morbidity and mortalitycin end stage renal disease // Am J Kidney Dis. 1996; 28: 53–61.
-
Volkova N., Arab L. Evidence-based systematic literature review of hemoglobin/hematocrit and all-cause mortality in dialysis patients // Am J Kidney Dis. 2006; 47: 24–36.
-
Strippoli G. F., Navaneethan S. D., Craig J. C. Haemoglobin and haematocrit targets for the anaemia of chronic kidney disease // Cochrane Database Syst Rev. 2006; 4. CD003967.
-
Besarab A., Bolton W. K., Browne J. K. et al. The effects of normal as compared with low hematocrit values in patients with cardiac disease who are receiving hemodialysis and epoetin // N Engl J Med. 1998; 339: 584–590
-
Strippoli G. F., Tognoni G., Navaneethan S. D. et al. Haemoglobin targets: we were wrong, time to move on // Lancet. 2007; 369: 346–350.
-
Phrommintikul A., Haas S. J., Elsik M. et al. Mortality and target haemoglobin concentrations in anaemic patients with chronic kidney disease treated with erythropoietin: a meta-analysis // Lancet. 2007; 369: 381–388
-
Locatelli F., Pisoni R. L., Combe C. et al. Anemia in haemodialysis patients of five European countries: association with morbidity and mortality in the Dialysis Outcomes and Practice Patterns Study (DOPPS) // Nephrol Dial Transpl. 2004; 19: 121–132.
-
Macdougall I. C., Tomson C. R. V., Steenkamp M., Ansell D. Relative risk of death in UK haemodialysis patients in relation to achieved haemoglobin from 1999 to 2005: an observational study using UK Renal Registry data incorporating 30,040 patient-years of follow-up // Nephrol. Dial. Transplant. 2010; 25 (3): 914–919.
-
Regidor D. L., Kopple J. D., Kovesdy C. P. et al. Associations between changes in hemoglobin and administered erythropoiesis-stimulating agent and survival in hemodialysis patients // J Am Soc Nephrol. 2006; 17: 1181–1191.
-
Fort J., Cuevas X., Garcia F., Perez-Garcia R., Llados F., Lozano J., Martin-Malo A. Mortality in incident haemodialysis patients: time-dependent haemoglobin levels and erythropoiesis-stimulating agent dose are independent predictive factors in the ANSWER study // Nephrol Dial Transpl. 2010; 25 (8): 2702–2710.
-
Block G. A., Hulbert-Shearon T. E., Levin N. E., Port F. K. Association of serum phosphorus and calcium ´ phosphorus product with mortality risk in chronic hemodialysis patients: a national study // Am J Kidney Dis. 1998; 31: 607–617.
-
Naves-Diaz M., Passlick-Deetjen J., Guinsburg A., Marelli C., Fernandez-Martin J. L., Rodriguez-Puyol D., Cannata J. B. Andia Calcium, phosphorus, PTH and death rates in a large sample of dialysis patients from Latin America. The CORES Study // Nephrol. Dial. Transplant., May 31, 2010.
-
Kalantar-Zadeh K., Kuwae N., Regidor D. L. et al. Survival predictability of time-varying indicators of bone disease in maintenance hemodialysis patients // Kidney Int. 2006; 70: 771–780.
-
Floege J., Kim J., Ireland E., Chazot C., Drueke T., de Francisco A., Kronenberg F., Marcelli D., Passlick-Deetjen J., Schernthaner G. et al. Serum iPTH, calcium and phosphate, and the risk of mortality in a European haemodialysis population // Nephrol. Dial. Transplant. 2010; 25.
-
National Kidney Foundation. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease // Am J Kidney Dis. 2003, 42: S1–S201.
-
Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease-mineral and bone disorder (CKD-MBD) // Kidney Int. 2009, 76: S1–S130.
-
Naves-Diaz M., Alvarez-Hernandez D., Passlick-Deetjen J. et al. Oral active vitamin D is associated with improved survival in hemodialysis patients // Kidney Int. 2008; 78 (8): 1070–1078.
-
Tentori F., Albert J. M., Young E. W. et al. The survival advantage for haemodialysis patients taking vitamin D is questioned: findings from the Dialysis Outcomes and Practice Patterns Study // Nephrol Dial Transplant. 2009; 24: 963–972.
-
Messa P., Macario F., Yaqoob M. et al. The OPTIMA study: assessing a new cinacalcet (Sensipar/Mimpara) treatment algorithm for secondary hyperparathyroidism // Clin J Am Soc Nephrol. 2008; 3: 36–45.
-
Urena P., Jacobson S. H., Zitt E. et al. Cinacalcet and achievement of the NKF/K-DOQI recommended target values for bone and mineral metabolism in real-world clinical practice — the ECHO observational study // Nephrol Dial Transplant. 2009; 24: 2852–2859.
-
Бикбов Б. Т., Томилина Н. А. Сосотояние заместительной почечной терапии больных с хронической почечной недостаточностью в Российской Федерации в 1998–2007 гг. (Аналитический отчет по данным Российского регистра заместительной почечной терапии) // Нефрология и диализ. 2009; 11 (3): 144–233.
-
Locatelli F., Zoccali C. And SIR SIN Study Investigators Clinical policies on the management of chronic kidney disease patients in Italy // Nephrol Dial Transplant. 2008; 23: 621–626.
-
Minutolo R., De Nicola L., Zamboli P. et al. Management of hypertension in patients with CKD: differences between primary and tertiary care settings // Am J Kidney Dis. 2005; 46: 18–25.
-
Young E. W., Akiba T., Albert J. M. et al. Magnitude and impact of abnormal mineral metabolism in hemodialysis patients in the dialysis outcomes and practice patterns study (DOPPS) // Am J Kidney Dis. 2004; 44 (Suppl 2): 34–38.
-
Locatelli F., Pisoni R. L., Combe C. et al. Anaemia in haemodialysis patients of five European countries: association with morbidity and mortality in the dialysis outcomes and practice patterns study (DOPPS) // Nephrol Dial Transplant. 2004; 19: 121–132.
-
Добронравов В. А., Смирнов А. В., Безруких А. М., Быстрова Н. Н., Дроздова Ю. В., Орлова С. А. Анемия и преддиализные стадии хронической болезни почек: клиническое значение, распространенность и факторы риска // Нефрология. 2006; 10 (3): 7–13.
-
Astor B. C., Muntner P., Levin A., Eustace J. A., Coresh J. Association of kidney function with anemia: the Third National Health and Nutrition Examination Survey (1988–1994) // Arch Intern Med. 2002; 162 (12): 1401–1408.
-
Cumming R. G., Mitchell P., Craig J. C., Knight J. F. Renal impairment and anaemia in a population-based study of older people // Intern Med J. 2004; 34 (1–2): 20–23.
-
Шостка Г. Д., Аниконова Л. И., Команденко М. С., Конакова И. Н., Земченков А. Ю., Константинов Ю. В., Шумилкин В. Р., Васильев А. Н., Тимофеев М. М., Тимаховская Г. Ю., Челноков Б. Н., Ряснянский В. Ю., Хадикова Н. Г., Дору-Товт В. П. Опыт лечения анемии у диализных пациентов в Санкт-Петербурге // Анемия. Журн. рабочей группы по анемии. 2005, № 4, 11–19.
-
Jacobs C., Frey D., Perkins A. C. Results of the European Survey on Anaemia Management 2003 (ESAM 2003): current status of anaemia management in dialysis patients, factors affecting epoetin dosage and changes in anaemia management over last 5 years // Nephrol Dial Transplant. 2005; 20 (suppl.): iii3–iii24.
-
Locatelli F., Pisoni R. L., Combe C, Bommer J., Andreucci V. E., Piera L., Greenwood R., Feldman H. I., Port F. K., Held P. J. Anaemia in haemodialysis patients of five European countries: association with morbidity and mortality in the Dialysis Outcomes and Practice Patterns Study (DOPPS) // Nephrol Dial Transplant. 2004; 19: 121–132.
-
DeFrancisco A. L.M., Macdougall I.C., Carrera F., Braun J., Barany P., Bridges I., Wheeler T., Tran D., Dietrich A. Intercurrent events and comorbid conditions influence hemoglobin level variability in dialysis patients // Clinical Nephrology. 2009; 71 (4): 397–404.
-
Fishbane S., Berns J. S. Hemoglobin cycling in hemodialysis patients treated with recombinant human erythropoietin // Kidney Int. 2005; 68 (3): 1337–1343.
-
Fishbane S. Recombinant human erythropoietin: has treatment reached its full potential // Semin Dial. 2006; 19 (1): 1–4.
-
Шило В. Ю., Хасабов Н. Н. Анемия у больных на диализе: дефицит железа, методы его диагностики и коррекции // Анемия. Журнал рабочей группы по анемии. 2004; 1: 19–28.
-
Lorenzo V., Martin-Malo A., Perez-Garcia R., Torregrosa J. V. et al. Prevalence, clinical correlates and therapy cost of mineral abnormalities among haemodialysis patients: a cross-sectional multicentre study // Nephrol Dial Transplant. 2006, 21: 459–465.
Г. Д. Шостка, доктор медицинских наук, профессор
В. Ю. Ряснянский, кандидат медицинских наук, доцент
ГОУ ВПО СПбГМА им. И. И. Мечникова, Санкт-Петербург
Контактная информация об авторах для переписки: ryasn2006@rambler.ru
Сопутствующие болезни, выявляемые у 5% больных и более
Средний уровень гемоглобина и распределение больных в зависимости от достижения целевого гемоглобина
Средний уровень ферритина сыворотки и частота выявления абсолютного дефицита железа
Частота назначения препаратов железа
Частота назначения и недельные дозы стимуляторов эритропоэза
Распределение больных в зависимости от целевых показателей фосфорно-кальциевого обмена
Купить номер с этой статьей в pdf









