За последние десятилетия спектр хронических болезней почек существенно расширился, что объясняется, прежде всего, ростом заболеваемости артериальной гипертонией, сахарным диабетом 2-го типа и атеросклерозом с учащением сосудистых поражений почек. Как следствие, в последние годы повсеместно отмечается тенденция к неуклонному росту числа больных, страдающих хронической почечной недостаточностью (ХПН). Так, в Москве за 10-летний период (с 1995 по 2004 г.) количество таких больных возросло в 4,7 раза. При этом ежегодная первичная обращаемость по поводу ХПН в течение всего этого срока оставалась стабильной и составляла около 1000 человек. С учетом летальности годовой прирост больных ХПН в Москве был стабилизирован в диапазоне 550–700 человек. Причем около 36% этих пациентов имеют терминальную стадию ХПН и нуждаются в гемодиализе [1].
Почка является одной из главных мишеней гипертонической болезни, и нарушения деятельности почек, наблюдающиеся при ней, часто представляются скорее следствием заболевания, чем его причиной. Кроме того, считается, что такие нарушения могут способствовать прогрессированию гипертонии. Но наряду с этим в основополагающих клинических исследованиях изменениям в почках уделяется лишь ограниченное внимание, а в большинстве случаев они и вовсе не рассматриваются. В то же время нефросклероз является наиболее частой конечной точкой продолжительного воздействия гипертонии на почки [2]. По современным представлениям, прогрессирование ХПН неизбежно сопряжено с развитием сердечно-сосудистых заболеваний. Закономерность этого феномена даже нашла отражение в представлении о так называемом кардиоренальном континууме [3].
Второй по значимости причиной ХПН является сахарный диабет. Диабетическая нефропатия развивается у 10–20% пациентов, страдающих сахарным диабетом, причем больные инсулинзависимым сахарным диабетом особенно подвержены этому осложнению. Диабетическая нефропатия обычно постепенно прогрессирует и приводит в большинстве случаев к неотвратимому развитию протеинурии, а затем к ХПН и смерти от уремии. Так, у 30–40% данной категории больных через 15–20 лет после клинического проявления болезни развивается терминальная стадия ХПН [4].
Однако кроме тяжелой соматической патологии у пациентов старшей возрастной группы зачастую имеется еще одна вероятная причина развития ХПН, а именно — аденома предстательной железы.
Доброкачественная гиперплазия предстательной железы (ДГПЖ) — одно из наиболее частых заболеваний, встречающихся у мужчин начиная с 40–50 лет и старше. Распространенность заболевания находится в возрастной зависимости и колеблется (по данным гистологических исследований) от 20% у мужчин в возрасте 41–50 лет до 50% в возрасте 51–60 лет и превышает 90% у мужчин старше 80 [5]. В последние годы стало очевидным, что, несмотря на доброкачественную природу, гиперплазия предстательной железы — это прогрессирующее заболевание, причем прогрессирование проявляется в усилении расстройств мочеиспускания, ухудшении качества жизни, возрастании риска острой задержки мочи и необходимости хирургического вмешательства [6].
Прогрессирующее развитие гиперплазии предстательной железы лежит в основе возникновения ряда осложнений: инфравезикальной обструкции, острой или хронической задержки мочеиспускания, возникновения камней мочевого пузыря, пузырно-мочеточникового рефлюкса, присоединения инфекции мочевыводящих путей, развития двустороннего уретрогидронефроза и ХПН [7]. Вместе с этим гиперплазия простаты является не только серьезной медицинской, но и большой социальной проблемой. Прогрессирующий характер течения, постепенное усугубление «симптомов нижних мочевых путей» приводят к частым осложнениям, а также, что наиболее важно, отрицательно сказываются на качестве жизни пациентов. В связи с этим не вызывает сомнения важность раннего выявления клинически значимых форм гиперплазии предстательной железы и своевременного назначения адекватного лечения [8].
До начала 90-х годов XX века оперативные вмешательства, такие как трансуретральная резекция простаты (ТУРП) и ее технические модификации были основными в лечении гиперплазии простаты. Однако по мере изучения ее этиологии и патогенеза появились эффективные лекарственные средства, и сегодня их можно разделить на три группы: альфа1-адреноблокаторы, ингибиторы 5-альфа-редуктазы и многочисленная группа растительных препаратов [9]. Медикаментозная терапия фактически стала самым широко распространенным методом лечения больных ДГПЖ. В результате ее применения существенно снизилось количество оперативных вмешательств по поводу гиперплазии простаты. Так, к примеру, в США число трансуретральных и открытых аденомэктомий уменьшилось с 250 тысяч в 1987 году до 88 тысяч в 2000 году [10].
Аналогичные тенденции прослеживаются и в других странах, в том числе и в России. Множество двойных слепых плацебо-контролируемых исследований было проведено с целью оценки эффективности применения у пациентов с симптомами ДГПЖ.
Было доказано, что кратковременное и длительное назначение альфа1-адреноблокаторов оказывает лечебное воздействие, устраняя динамический компонент инфравезикальной обструкции посредством расслабления гладкой мускулатуры простаты и шейки мочевого пузыря вследствие блокады альфа1-адренорецепторов [11]. Из широкого спектра альфа1-адреноблокаторов, применяемых в терапии доброкачественной гиперплазии предстательной железы, особого внимания заслуживает доксазозина мезилат, входящий в состав препарата Кардура.
Терапия доксазозином способствует регрессии гипертрофии левого желудочка, улучшению чувствительности к инсулину, снижению артериального давления, а также нормализации уровня липидов крови, что в свою очередь приводит к снижению риска развития ишемической болезни сердца и ХПН. Однако влияние ДГПЖ и ее фармакотерапевтической коррекции на клиническое течение ХПН на фоне имеющейся у пациентов соматической патологии недостаточно освещено в современной литературе и поэтому требует детального изучения.
Авторами было запланировано и проведено исследование, целью которого явилось определение особенностей клинического течения ХПН у пациентов с соматической патологией и ДГПЖ. В первой части исследования были оценены заключения 681 протокола патолого-анатомического вскрытия мужчин, поступивших в крупный многопрофильный стационар Москвы по каналу скорой медицинской помощи в период 2005–2007 гг. по поводу декомпенсации соматической патологии. Средний возраст больных на момент смерти составил 59,3 ± 14,7 года.
Согласно материалам патолого-анатомической службы стационара к смерти этих пациентов в 141 (20,7%) случае привела острая коронарная патология, в 196 (28,8%) — сердечная недостаточность, в 192 (28,2%) — острая цереброваскулярная патология (116 инфарктов головного мозга и 76 кровоизлияний в головной мозг) и в 152 (22,3%) случаях — хроническая обструктивная болезнь легких (рис. 1).
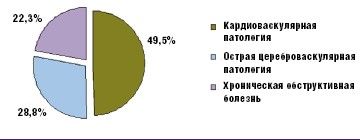
При этом у 524 (77%) умерших мужчин при жизни была диагностирована артериальная гипертензия различных степеней и тяжести, а у 181 (27%) сахарный диабет 2-го типа.
Кроме того, у 76 (11%) пациентов в анамнезе имелось комбинированное лечение по поводу злокачественных образований различных локализаций, а у 95 (14%) — хроническая алкогольная интоксикация [12].
Патолого-анатомическое вскрытие включенных в исследование мужчин открыло дополнительные нозологии и осложнения вышеуказанных заболеваний.
Наиболее частыми осложнениями включенных в исследование пациентов явились ХПН различной степени тяжести (62,3%), тромбоэмболия легочной артерии и ее ветвей (45,1%), отек легких (36,4%), нарушение архитектоники головного мозга (31,3%), пневмония (22,7%), эрозивно-язвенное поражение слизистой оболочки желудочно-кишечного тракта (18,4%), пароксизмальная или постоянная форма мерцательной аритмии (14,3%) (рис. 2).
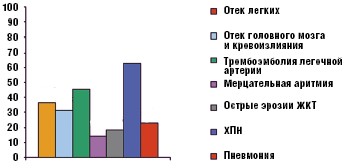
Необходимо заметить, что такое наиболее часто встречающееся осложнение у пациентов с соматической патологией, как ХПН, диагностировалось клиницистами на 19% реже, чем патологоанатомами, что отражается в отсутствии данной нозологии в формулировке клинического диагноза 82 из 424 пациентов. Все 424 пациента с ХПН, вошедшие в исследование, имели разную стадию и тяжесть течения данного состояния.
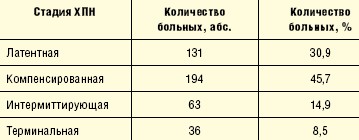
Согласно общепринятой урологической классификации, утвержденной на I Всесоюзном съезде урологов (1972 г.), существует четыре стадии ХПН, критериями определения которых являются: скорость клубочковой фильтрации (СКФ), концентрация мочевины и креатинина крови. Однако на практике для прижизненного уточнения диагноза ХПН клиренс эндогенного креатинина определяют крайне редко, что мотивировано трудностью выполнения и отсутствием условий, необходимых для проведения данной процедуры в отделениях стационара у широкого круга больных. Поэтому диагностика ХПН зачастую основана на определении биохимических показателей крови, а именно креатинина и мочевины.
Распределение включенных в исследование больных в зависимости от стадии ХПН, определенной в соответствии с данной классификацией, представлено в табл. 1.
У этих же пациентов при аутопсии было обнаружено, что 372 (54%) мужчины имели ДГПЖ. Необходимо заметить, что во всех случаях посмертной диагностики гиперплазия простаты была вынесена врачами-морфологами в раздел «Сопутствующая патология» патолого-анатомического диагноза. Тем самым подчеркивалась непричастность вышеуказанной нозологии к неблагоприятному исходу умерших больных и не устанавливалась патогенетическая связь между гиперплазией, ХПН и соматической патологией.
При жизни же ДГПЖ была диагностирована и вынесена в формулировку окончательного клинического диагноза лишь у 7% пациентов. Этот процент, в большинстве случаев, был ассоциирован с возникновением и лечением осложнений ДГПЖ, таких как острая задержка мочеиспускания, гематурия, образование камней мочевого пузыря с развитием цистита и последующей инфравезикальной обструкции, уретрит, простатит, острый и хронический пиелонефрит и т. д. Ни в одном случае не было проведено должной оценки возможной взаимосвязи развития ХПН как результата ДГПЖ. Согласно же проведенному анализу ХПН при наличии ДГПЖ встречается на 12% процентов чаще, чем при ее отсутствии (рис. 3).
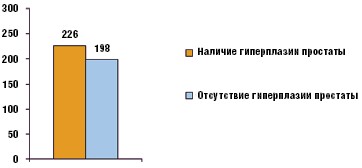
Руководствуясь именно этими данными, из указанных протоколов секционного заключения для дальнейшего исследования нами было сформировано две группы больных. В группу «A» были включены 198 пациентов, у которых на секции была выявлена ХПН, но не обнаружена ДГПЖ. В группу «B» вошли 226 больных, у которых при аутопсии обнаружены и ХПН, и ДГПЖ. Перечень осложнений и их удельного веса в структуре основных причин смерти обеих групп пациентов с ХПН представлен в табл. 2.

При этом течение ХПН, отражающееся в концентрации креатинина, цифрах систолического (САД) и диастолического артериального давления (ДАД), а также резистентности к мочегонной терапии, было тяжелее у пациентов с комбинацией ХПН и ДГПЖ (табл. 3).

Необходимо заметить, что всем пациентам, страдающим ХПН различной степени тяжести, в стационаре назначалась терапия с участием ингибиторов АПФ, антагонистов рецепторов ангиотензина II, альфа- и бета-адреноблокаторов, антагонистов кальция и диуретиков [11]. Как видно из табл. 4, средняя частота назначения альфа-адреноблокаторов у пациентов с ХПН составляла порядка 7% от общего количества данных больных, что, вероятно, связано с низкой частотой прижизненной диагностики ДГПЖ в условиях терапевтической клиники.
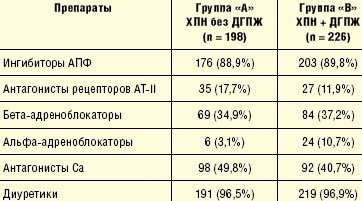
Таким образом, у пациентов с дестабилизацией соматической патологии, находящихся на лечении в терапевтических отделениях стационара, отмечается высокая распространенность ХПН различной стадии и степени тяжести, а также доброкачественной гиперплазии предстательной железы, которая диагностируется своевременно лишь у малого числа больных.
Следующая часть исследования заключалась в проспективном изучении особенностей клинического течения ХПН у больных с ДГПЖ или ее отсутствием на фоне дестабилизации соматической патологии, а также установлении возможных патогенетических взаимосвязей между ДГПЖ и ХПН.
В исследование в течение трех месяцев включались все поступающие в терапевтические отделения стационара пациенты мужского пола с клинической и лабораторной симптоматикой ХПН, развившейся в результате артериальной гипертензии и/или сахарного диабета. Через три месяца количество таких пациентов составило 217 человек.
На момент начала исследования анамнестически ДГПЖ не была диагностирована ни у одного поступившего. В последующем все пациенты были обследованы на предмет наличия ДГПЖ, а в случае обнаружения последней у них активно проводилось выявление нарушений мочеиспускания и других клинических маркеров ДГПЖ, в том числе использовалась валидизированная анкета IPSS (International Prostatae Symptom Scale). Данная шкала выражается в баллах и при суммарном их количестве больше 8 и меньше 19 является показанием к медикаментозному лечению. Всем больным с целью определения размеров органов было выполнено УЗИ почек и предстательной железы. Также все пациенты были осмотрены и консультированы урологом. После проведенного скрининга госпитализированных за три месяца мужчин с симптомами ХПН, ДГПЖ различной степени тяжести была выявлена у 144 пациентов, что составило 66,4% от общего количества (рис. 4)
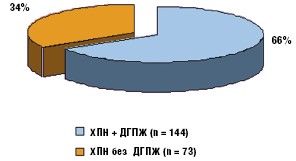
В последующем было сформировано две группы. В группу I включены 73 пациента, у которых на фоне имеющейся соматической патологии была диагностирована ХПН, но отсутствовали клинические и УЗИ-признаки ДГПЖ. В группу II были включены выявленные 144 пациента с сочетанием ХПН и ДГПЖ (табл. 5).
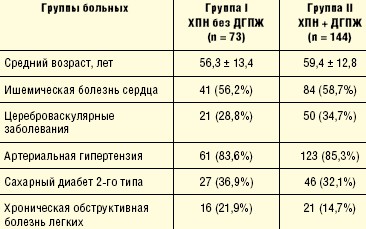
На данном этапе работы выявлено, что анамнестические, клинические, лабораторные и инструментальные показатели были тяжелее, а средний объем почек на порядок меньше у мужчин с ХПН при наличии ДГПЖ (табл. 6).
При этом результаты ультразвуковой диагностики линейных размеров и объема предстательной железы у пациентов с ХПН и ДГПЖ и без нее также отличались. Кроме того, при корреляционном анализе была выявлена достоверная прямая связь между наличием и степенью гиперкреатининемии и азотемии с объемом предстательной железы.
Таким образом, ДГПЖ утяжеляет течение хронической почечной недостаточности, развившейся в результате того или иного кардиоваскулярного заболевания и/или сахарного диабета, а отсутствие начатой в первые дни стационарного лечения терапии ДГПЖ приводит к усугублению прогноза пациентов и недостаточной эффективности терапии основного заболевания.
Заключительная часть исследования состояла в изучении роли фармакологической коррекции гиперплазии предстательной железы у пациентов с симптомами ХПН на фоне дестабилизации соматической патологии. В данный этап исследования были включены 144 мужчины с ХПН и ДГПЖ, верифицированные во время проспективной части работы.
Все пациенты методом пар были разделены на две равночисленные группы (1 и 2) по 72 человека в каждой, сопоставимые по возрасту, антропометрическим данным, степени ДГПЖ и тяжести клинических, лабораторных и ультразвуковых критериев и проявлений ХПН.
Всем мужчинам группы 1 с первых часов стационарного лечения назначался альфа1-адреноблокатор — доксазозина мезилат (Кардура) начиная с дозы 1 мг 1 раз в сутки с ее постепенным увеличением и дальнейшим приемом препарата в дозировке 4 мг (1 таблетка) 1 раз в сутки утром. Препарат пациенты принимали внутрь после завтрака, запивая достаточным количеством воды. Курс лечения доксазозином составил 90 дней, 15 из которых пациенты провели в стационаре.
Пациентам группы 2 терапия ДГПЖ не проводилась. Подробная характеристика обеих групп пациентов до начала исследования представлена в табл. 7.

Контрольное обследование проводилось при выписке (14-й день) и через три месяца после выписки из стационара и включало определение тех же параметров, что в начале исследования. В результате проведенного исследования было отмечено благоприятное действие доксазозина мезилата, проявляющееся в улучшении качества жизни пациентов и положительной динамике исследуемых показателей уро- и гемодинамики.
Так, на фоне проводимой гипотензивной терапии с добавлением доксазозина мезилата в поддерживающей дозе 4 мг однократно утром было выявлено достоверное снижение как САД, так и ДАД. При этом целевой уровень артериального давления (120–139/80–89 мм рт. ст.) был достигнут у 34 (45%) больных. В контрольной группе, в которой пациенты получали стандартную идентичную гипотензивную терапию, включающую бета-блокаторы, ингибиторы АПФ, антагонисты рецепторов ангиотензина-II, антагонисты кальция и т. д., отмечалось также достоверное снижение цифр артериального давления, но достичь целевого артериального давления смогли лишь 15 (11%) пациентов (рис. 5).
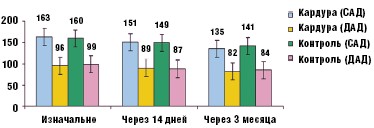
Таким образом, у больных ДГПЖ и артериальной гипертензией доксазозина мезилат приводит к существенному снижению артериального давления, а при исходно нормальных его значениях гипотензивный эффект практически отсутствует.
Через 14 дней терапии доксазозином средние уровни креатинина и мочевины крови снизились до 148,2 ммоль/л и 9,9 мкмоль/л соответственно, а через 90 дней — до 117,8 ммоль/л и 7,8 мкмоль/л соответственно. В группе контроля наблюдалось менее интенсивное снижение уровня данных показателей (рис. 6 и 7).
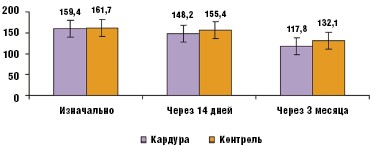
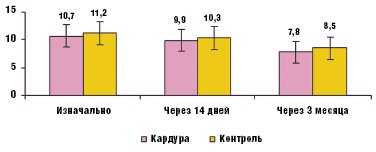
Таким образом, уровни креатинина и мочевины крови в экспериментальной группе за три месяца терапии снизились на 26,1% и 27,1%, по сравнению с 18,3% и 24,1% в группе контроля соответственно.
За 14 дней терапии доксазозина мезилатом СКФ увеличилась до 29,6 мл/мин/1,7 м2, а через 90 дней — до 36,7 мл/мин/1,7 м2. В группе контроля наблюдалась лишь относительная динамика эндогенного клиренса креатинина.
Таким образом, СКФ в группе доксазозина за три месяца терапии увеличилась на 33,8% по сравнению с 14,1% в группе контроля.
У всех 144 пациентов до включения в исследование миокард был значительно гипертрофирован. В группе доксазозина мезилата в ходе терапии мы наблюдали дальнейшее увеличение массы миокарда левого желудочка (ММЛЖ), которая через 90 дней лечения составляла в среднем 382,2 г. Однако в контрольной группе отмечалось более значимое увеличение ММЛЖ — до 412,6 г.
Таким образом, ММЛЖ увеличилась в обеих группах, однако если на фоне комбинированной гипотензивной терапии с участием препарата Кардура степень прироста массы составила всего 4,6%, то в контрольной группе — 11,6%.
Трехмесячная терапия доксазозином способствовала ослаблению признаков инфравезикальной обструкции, уменьшив обструктивную симптоматику и количество остаточной мочи (на 48,2% против 10,4% в группе контроля).
При этом показатели объема предстательной железы практически не изменялись, в то время как объем почек продолжал уменьшаться более интенсивно у пациентов, не получающих терапию ДГПЖ.
Кроме того, длительное лечение доксазозина мезилатом не влияло на уровень общего простатического специфического антигена (ПСА) (рис. 8).
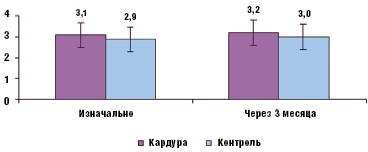
Таким образом, полученные результаты позволяют широко использовать доксазозина мезилат (Кардура) в терапии пациентов с соматической патологией, страдающих ХПН и ДГПЖ.
Литература
-
Томилина Н. А. Хроническая почечная недостаточность // Медицинская газета, № 52, 2005.
-
Brunner F. P., Selwood N. H. Profile of patients on RRT in Europe and death rates due to major causes of death groups//Kidney Int., 1992.
-
Eknoyan G. Cardiovascular Mortality and Morbidity in Dialysis Patients // Mineral and Electrolyte Metabolism, 1999, № 1.
-
Дедов И. И., Шестакова М. В. Диабетическая нефропатия. М.: Изд. Универсум Паблишинг, 2000.
-
Joseph C., Presti Jr. Benign Prostatic Hyperplasia Incidence and Epidemiology, 2007.
-
Григорян В. А., Дымов А. М. Медикаментозная терапия больных гиперплазией простаты с использованием a1-адреноблокаторов //РМЖ, 2007, № 29.
-
Лопаткин Н. А. Доброкачественная гиперплазия предстательной железы. М., 1999.
-
Лопаткин Н. А., Аляев Ю. Г., Коган М. И., Лоран О. Б., Мазо Е. Б., Степанов В. Н. Эффективность и безопасность применения доксазозина при лечении больных с доброкачественной гиперплазией предстательной железы // Урология, 2003, № 5.
-
Лоран О. Б., Лукьянов И. В. Практическая урология: что нового в лечении ДГПЖ — взгляд эксперта // РМЖ, 2008, № 29.
-
EAU Recommendations on Benign Prostatic Hyperplasia, update March 2004.
-
AUA guideline on the management of benign prostatic hyperplasia, 2003.
-
Верткин А. Л., Скотников А. С., Адонина Е. В., Галкин И. В., Звягинцева Е. И., Стахнев Е. Ю. Место блокаторов рецепторов ангиотензина в терапии артериальной гипертензии у пациентов с полипатией //Русский медицинский журнал. 2009, № 8.
А. Л. Верткин, доктор медицинских наук, профессор
Е. Ю. Стахнев
А. С. Скотников
МГМСУ, Москва
Контактная информация об авторах для переписки: skotnikov.as@mail.ru
Купить номер с этой статьей в pdf









