Микрофлора кишечника человека является составляющей человеческого организма и выполняет многочисленные жизненно важные функции. Общая численность микроорганизмов, обитающих в различных частях макроорганизма, приблизительно на два порядка превышает численность его собственных клеток и составляет около 1014–15. Совокупный вес микроорганизмов человеческого тела составляет около 3–4 кг. Наибольшее число микроорганизмов приходится на желудочно-кишечный тракт (ЖКТ), включая ротоглотку (75–78%), остальные заселяют мочеполовые пути (до 2–3% у мужчин и до 9–12% у женщин) и кожные покровы.
У здоровых лиц в кишечнике насчитывается более 500 видов микроорганизмов. Общая масса микрофлоры кишечника составляет от 1 до 3 кг. В разных отделах ЖКТ количество бактерий различно, большинство микроорганизмов локализованы в толстой кишке (около 1010–12 КОЕ/мл, что составляет 35–50% ее содержимого). Состав кишечной микрофлоры достаточно индивидуален и формируется с первых дней жизни ребенка, приближаясь к показателям взрослого к концу 1-го — 2-му году жизни, претерпевая некоторые изменения в пожилом возрасте (табл. 1). У здоровых детей в толстой кишке обитают представители факультативно-анаэробных бактерий рода Streptococcus, taphylococcus, Lactobacillus, nterobacteriacae, Candida и более чем 80% биоценоза занимают анаэробные бактерии, чаще грамположительные: пропионобактерии, вейлонеллы, эубактерии, анаэробные лактобациллы, пептококки, пептострептококки, а также грамотрицательные бактероиды и фузобактерии.
Распределение микроорганизмов по ходу ЖКТ имеет достаточно строгие закономерности и тесно коррелирует с состоянием пищеварительной системы (табл. 2). Большинство микроорганизмов (около 90%) присутствуют в тех или иных отделах постоянно и являются основной (резидентной) микрофлорой; около 10% составляет факультативная (или добавочная, сопутствующая микрофлора); и 0,01–0,02% приходится на долю случайных (или транзиторных, остаточных) микроорганизмов. Условно принято считать, что главная микрофлора толстой кишки представлена анаэробными бактериями, тогда как аэробные бактерии составляют сопутствующую микрофлору. Стафилококки, клостридии, протей и грибы относятся к остаточной микрофлоре. Помимо этого, в толстой кишке выявляются около 10 кишечных вирусов и некоторые представители непатогенных простейших. Облигатных и факультативных анаэробов в толстой кишке всегда на порядок больше, чем аэробов, причем строгие анаэробы непосредственно адгезированы на эпителиоцитах, выше располагаются факультативные анаэробы, далее — аэробные микроорганизмы. Таким образом, анаэробные бактерии (в основном бифидобактерии и бактероиды, суммарная доля которых составляет около 60% от общего количества анаэробных бактерий) являются наиболее постоянной и многочисленной группой микрофлоры кишечника, осуществляющей основные функции.
Вся совокупность микроорганизмов и макроорганизм составляют своеобразный симбиоз, где каждый извлекает выгоды для своего существования и оказывает влияние на партнера. Функции кишечной микрофлоры по отношению к макроорганизму реализуются как локально, так и на системном уровне, при этом различные виды бактерий вносят свой вклад в это влияние. Микрофлора пищеварительного тракта выполняет следующие функции.
- Морфокинетические и энергетические эффекты (энергообеспечение эпителия, регулирование перистальтики кишечника, тепловое обеспечение организма, регуляция дифференцировки и регенерации эпителиальных тканей).
- Формирование защитного барьера слизистой оболочки кишечника, подавление роста патогенной микрофлоры.
- Иммуногенная роль (стимуляция иммунной системы, стимуляция местного иммунитета, в том числе выработки иммуноглобулинов).
- Модуляция функций цитохромов Р450 в печени и продукция Р450-схожих цитохромов.
- Детоксикация экзогенных и эндогенных токсических субстанций и соединений.
- Продукция разнообразных биологически активных соединений, активация некоторых лекарственных препаратов.
- Мутагенная/антимутагенная активность (повышение резистентности эпителиальных клеток к мутагенам (канцерогенам), разрушение мутагенов).
- Регуляция газового состава полостей.
- Регуляция поведенческих реакций.
- Регуляция репликации и экспрессии генов прокариотических и эукариотических клеток.
- Регуляция запрограммированной гибели эукариотических клеток (апоптоза).
- Хранилище микробного генетического материала.
- Участие в этиопатогенезе заболеваний.
- Участие в водно-солевом обмене, поддержание ионного гомеостаза организма.
- Формирование иммунологической толерантности к пищевым и микробным антигенам.
- Участие в колонизационной резистентности.
- Обеспечение гомеостаза симбиотических взаимоотношений прокариотических и эукариотических клеток.
- Участие в обмене веществ: метаболизме белков, жиров (поставка субстратов липогенеза) и углеводов (поставка субстратов глюконеогенеза), регуляция желчных кислот, стероидов и др. макромолекул.
Так, бифидобактерии за счет ферментации олиго- и полисахаридов продуцируют молочную кислоту и ацетат, которые обеспечивают бактерицидную среду, секретируют вещества-ингибиторы роста патогенных бактерий, что повышает резистентность организма ребенка к кишечным инфекциям. Модуляции иммунного ответа ребенка бифидобактериями также выражаются в снижении риска развития пищевой аллергии.
Лактобациллы уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие.
Из представителей энтеробактерий наиболее важное значение имеет Escherichia coli M17, которая вырабатывает колицин В, за счет чего подавляет рост шигелл, сальмонелл, клебсиелл, серраций, энтеробактеров и оказывает незначительное влияние на рост стафилококков и грибов. Также кишечная палочка способствуют нормализации микрофлоры после антибактериальной терапии и воспалительных и инфекционных заболеваний.
Энтерококки (Enterococcus avium, faecalis, faecium) стимулируют местный иммунитет за счет активации В-лимфоцитов и повышения синтеза IgA, высвобождения интерлейкинов-1β и -6, γ-интерферона; обладают противоаллергическим и антимикотическим действием.
Кишечные палочки, бифидо- и лактобактерии выполняют витаминообразующую функцию (участвуют в синтезе и всасывании витаминов К, группы В, фолиевой и никотиновой кислот). По способности синтезировать витамины кишечная палочка превосходит все остальные бактерии кишечной микрофлоры, синтезируя тиамин, рибофлавин, никотиновую и пантотеновую кислоты, пиридоксин, биотин, фолиевую кислоту, цианокобаламин и витамин К. Бифидобактерии синтезируют аскорбиновую кислоту, бифидо- и лактобактерии способствуют всасыванию кальция, витамина D, улучшают всасывание железа (благодаря созданию кислой среды).
Процесс пищеварения условно можно разделить на собственное (дистанционное, полостное, аутолитическое и мембранное), осуществляемое ферментами организма, и симбиозное пищеварение, происходящее при содействии микрофлоры. Микрофлора кишечника человека участвует в ферментации нерасщепленных ранее компонентов пищи, главным образом углеводов, таких, как крахмал, олиго- и полисахариды (в том числе и целлюлоза), а также белков и жиров.
Не всосавшиеся в тонкой кишке белки и углеводы в слепой кишке подвергаются более глубокому бактериальному расщеплению — преимущественно кишечной палочкой и анаэробами. Конечные продукты, образующиеся в результате процесса бактериальной ферментации, оказывают различное влияние на состояние здоровья человека. Например, бутират необходим для нормального существования и функционирования колоноцитов, является важным регулятором их пролиферации и дифференцировки, а также всасывания воды, натрия, хлора, кальция и магния. Вместе с другими летучими жирными кислотами он оказывает влияние на моторику толстой кишки, в одних случаях ускоряя ее, в других — замедляя. При расщеплении полисахаридов и гликопротеинов внеклеточными микробными гликозидазами образуются, помимо прочего, моносахариды (глюкоза, галактоза и т. д.), при окислении которых в окружающую среду выделяется в виде тепла не менее 60% их свободной энергии.
Среди важнейших системных функций микрофлоры — поставка субстратов глюконеогенеза, липогенеза, а также участие в метаболизме белков и рециркуляции желчных кислот, стероидов и других макромолекул. Превращение холестерина в не всасывающийся в толстой кишке копростанол и трансформация билирубина в стеркобилин и уробилин возможны только при участии бактерий, находящихся в кишечнике.
Протективная роль сапрофитной флоры реализуется как на местном, так и на системном уровнях. Создавая кислую среду, благодаря образованию органических кислот и снижению рН среды толстой кишки до 5,3–5,8, симбионтная микрофлора защищает человека от колонизации экзогенными патогенными микроорганизмами и подавляет рост уже имеющихся в кишечнике патогенных, гнилостных и газообразующих микроорганизмов. Механизм этого явления заключается в конкуренции микрофлоры за питательные вещества и участки связывания, а также в выработке нормальной микрофлорой определенных ингибирующих рост патогенов субстанций, обладающих бактерицидной и бактериостатической активностью, в том числе антибиотикоподобных. Низкомолекулярные метаболиты сахаролитической микрофлоры, в первую очередь летучие жирные кислоты, лактат и др., обладают заметным бактериостатическим эффектом. Они способны ингибировать рост сальмонелл, дизентерийных шигелл, многих грибов.
Также кишечная микрофлора усиливает местный кишечный иммунологический барьер. Известно, что у стерильных животных в lamina propria определяется очень малое количество лимфоцитов, кроме того, у этих животных наблюдается иммунодефицит. Восстановление нормальной микрофлоры быстро приводит к увеличению количества лимфоцитов в слизистой кишечника и исчезновению иммунодефицита. Сапрофитные бактерии в определенной степени обладают способностью модулировать уровень фагоцитарной активности, снижая его у людей, страдающих аллергией и, наоборот, повышая его у здоровых индивидуумов.
Таким образом, микрофлора ЖКТ не только формирует местный иммунитет, но и играет огромную роль в становлении и развитии иммунной системы ребенка, а также поддерживает ее активность у взрослого. Резидентная флора, особенно некоторые микроорганизмы, обладают достаточно высокими иммуногенными свойствами, что стимулирует развитие лимфоидного аппарата кишечника и местный иммунитет (в первую очередь за счет усиления продукции ключевого звена системы местного иммунитета — секреторного IgA), а также приводит к системному повышению тонуса иммунной системы, с активацией клеточного и гуморального звеньев иммунитета. Системная стимуляция иммунитета — одна из важнейших функций микрофлоры. Известно, что у безмикробных лабораторных животных не только подавлен иммунитет, но и происходит инволюция иммунокомпетентных органов. Поэтому при нарушениях микроэкологии кишечника, дефиците бифидофлоры и лактобацилл, беспрепятственном бактериальном заселении тонкой и толстой кишки возникают условия для снижения не только местной защиты, но и резистентности организма в целом.
Несмотря на достаточную иммуногенность, сапрофитные микроорганизмы не вызывают реакций иммунной системы. Возможно, это происходит потому, что сапрофитная микрофлора является своего рода хранилищем микробных плазмидных и хромосомных генов, обмениваясь генетическим материалом с клетками хозяина. Реализуются внутриклеточные взаимодействия путем эндоцитоза, фагоцитоза и пр. При внутриклеточных взаимодействиях достигается эффект обмена клеточным материалом. В результате представители микрофлоры приобретают рецепторы и другие антигены, присущие хозяину. Это делает их «своими» для иммунной системы макроорганизма. Эпителиальные ткани в результате такого обмена приобретают бактериальные антигены.
Обсуждается вопрос о ключевом участии микрофлоры в обеспечении противовирусной защиты хозяина. Благодаря феномену молекулярной мимикрии и наличию рецепторов, приобретенных от эпителия хозяина, микрофлора становится способной к перехвату и выведению вирусов, обладающих соответствующими лигандами.
Таким образом, наряду с низким рН желудочного сока, двигательной и секреторной активностью тонкой кишки, микрофлора ЖКТ относится к неспецифическим факторам защиты организма.
Важной функцией микрофлоры является синтез ряда витаминов. Человеческий организм получает витамины в основном извне — с пищей растительного или животного происхождения. Поступающие витамины в норме всасываются в тонкой кишке и частично утилизируются кишечной микрофлорой. Микроорганизмы, населяющие кишечник человека и животных, продуцируют и утилизируют многие витамины. Примечательно, что наиболее важную роль для человека в этих процессах играют микробы тонкой кишки, так как продуцируемые ими витамины могут эффективно всасываться и поступать в кровоток, тогда как витамины, синтезирующиеся в толстой кишке, практически не всасываются и для человека оказываются недоступными. Подавление микрофлоры (например, антибиотиками) снижает и синтез витаминов. Наоборот, создание благоприятных для микроорганизмов условий, например при употреблении в пищу достаточного количества пребиотиков, повышает обеспеченность макроорганизма витаминами.
Наиболее изучены в настоящее время аспекты, связанные с синтезом кишечной микрофлорой фолиевой кислоты, витамина В12 и витамина К.
Фолиевая кислота (витамин В9), поступая с продуктами питания, эффективно всасывается в тонкой кишке. Синтезирующийся в толстой кишке представителями нормальной кишечной микрофлоры фолат идет исключительно для ее собственных нужд и не утилизируется макроорганизмом. Тем не менее синтез фолата в толстой кишке может иметь большое значение для нормального состояния ДНК колоноцитов.
Кишечные микроорганизмы, синтезирующие витамин В12, обитают как в толстой, так и в тонкой кишке. Среди этих микроорганизмов наиболее активны в данном аспекте представители Pseudomonas и Klebsiella sp. Однако возможностей микрофлоры для полной компенсации гиповитаминоза В12 оказывается недостаточно.
С содержанием в просвете толстой кишки фолата и кобаламина, полученных с пищей или синтезированных микрофлорой, связана способность эпителия кишечника противостоять процессам канцерогенеза. Предполагается, что одной из причин более высокой частоты опухолей толстой кишки, по сравнению с тонкой, является недостаток цитопротекторных составляющих, большинство из которых всасывается в средних отделах ЖКТ. Среди них — витамин В12 и фолиевая кислота, которые совместно определяют стабильность клеточных ДНК, в частности ДНК клеток эпителия толстой кишки. Даже незначительный дефицит этих витаминов, не вызывающий анемию или другие тяжелые последствия, тем не менее приводит к значимым аберрациям в молекулах ДНК колоноцитов, способным стать основой канцерогенеза. Известно, что недостаточное поступление к колоноцитам витаминов В6, В12 и фолиевой кислоты ассоциируется с повышенной частотой рака толстой кишки в популяции. Дефицит витаминов приводит к нарушению процессов метилирования ДНК, мутациям и, как следствие, раку толстой кишки. Риск толстокишечного канцерогенеза повышается при низком потреблении пищевых волокон и овощей, обеспечивающих нормальное функционирование кишечной микрофлоры, синтезирующей трофические и протективные в отношении толстой кишки факторы.
Витамин К существует в нескольких разновидностях и необходим человеческому организму для синтеза различных кальцийсвязывающих белков. Источником витамина К1, филохинона, являются продукты растительного происхождения, а витамин К2, группа соединений менахинонов, синтезируется в тонкой кишке человека. Микробный синтез витамина К2 стимулируется при недостатке филохинона в диете и вполне способен его компенсировать. В то же время недостаточность витамина К2 при сниженной активности микрофлоры плохо корригируется диетическими мероприятиями. Таким образом, синтетические процессы в кишечнике являются приоритетными для обеспечения макроорганизма этим витамином. Витамин К синтезируется и в толстой кишке, но используется преимущественно для потребностей микрофлоры и колоноцитов.
Кишечная микрофлора принимает участие в детоксикации экзогенных и эндогенных субстратов и метаболитов (аминов, меркаптанов, фенолов, мутагенных стероидов и др.) и, с одной стороны, представляет собой массивный сорбент, выводя из организма токсические продукты с кишечным содержимым, а с другой — утилизирует их в реакциях метаболизма для своих нужд. Помимо этого, представители сапрофитной микрофлоры продуцируют на основе конъюгатов желчных кислот эстрагеноподобные субстанции, оказывающие влияние на дифференцировку и пролиферацию эпителиальных и некоторых других тканей путем изменения экспрессии генов или характера их действия.
Итак, взаимоотношения микро- и макроорганизма носят сложный характер, реализующийся на метаболическом, регуляторном, внутриклеточном и генетическом уровне. Однако нормальное функционирование микрофлоры возможно только при хорошем физиологическом состоянии организма и в первую очередь нормальном питании.
Питание микроорганизмов, населяющих кишечник, обеспечивается за счет нутриентов, поступающих из вышележащих отделов ЖКТ, которые не перевариваются собственными ферментативными системами и не всасываются в тонкой кишке. Эти вещества необходимы для обеспечения энергетических и пластических потребностей микроорганизмов. Способность использовать нутриенты для своей жизнедеятельности зависит от ферментативных систем различных бактерий.
В зависимости от этого условно выделяют бактерии с преимущественно сахаролитической активностью, основным энергетическим субстратом которых являются углеводы (характерно в основном для сапрофитной флоры), с преимущественной протеолитической активностью, использующих белки для энергетических целей (характерно для большинства представителей патогенной и условно-патогенной флоры), и смешанной активностью. Соответственно, преобладание в пище тех или иных нутриентов, нарушение их переваривания будет стимулировать рост различных микроорганизмов.
Углеводные нутриенты особенно необходимы для жизнедеятельности нормальной кишечной микрофлоры. Ранее эти компоненты пищи называли «балластными», предполагая, что они не имеют какого-либо существенного значения для макроорганизма, однако по мере изучения микробного метаболизма стало очевидно их значение не только для роста кишечной микрофлоры, но для здоровья человека в целом. Согласно современному определению, пребиотиками называют частично или полностью не перевариваемые компоненты пищи, которые избирательно стимулируют рост и/или метаболизм одной или нескольких групп микроорганизмов, обитающих в толстой кишке, обеспечивая нормальный состав кишечного микробиоценоза. Свои энергетические потребности микроорганизмы толстой кишки обеспечивают за счет анаэробного субстратного фосфорилирования, ключевым метаболитом которого является пировиноградная кислота (ПВК). ПВК образуется из глюкозы в процессе гликолиза. Далее, в результате восстановления ПВК, образуется от одной до четырех молекул аденозинтрифосфата (АТФ). Последний этап приведенных выше процессов обозначается как брожение, которое может идти различными путями с образованием различных метаболитов.
Гомоферментативное молочное брожение характеризуется преимущественным образованием молочной кислоты (до 90%) и характерно для лактобактерий и стрептококков толстой кишки. Гетероферментативное молочное брожение, при котором образуются и другие метаболиты (в том числе уксусная кислота), присуще бифидобактериям. Спиртовое брожение, ведущее к образованию углекислого газа и этанола, является побочным метаболическим эффектом у некоторых представителей Lactobacillus и Clostridium. Отдельные виды энтеробактерий (E. coli) и клостридий получают энергию в результате муравьинокислого, пропионового, маслянокислого, ацетонобутилового или гомоацетатного видов брожения.
В результате микробного метаболизма в толстой кишке образуются молочная кислота, короткоцепочечные жирные кислоты (С2 — уксусная; С3 — пропионовая; С4 — масляная/изомасляная; С5 — валериановая/изовалериановая; С6 — капроновая/изокапроновая), углекислый газ, водород, вода. Углекислый газ в большой степени преобразуется в ацетат, водород всасывается и выводится через легкие, а органические кислоты (в первую очередь жирные короткоцепочечные) утилизируются макроорганизмом. Нормальная микрофлора толстой кишки, перерабатывая не переваренные в тонкой кишке углеводы, производит короткоцепочечные жирные кислоты с минимальным количеством их изоформ. В то же время при нарушении микробиоценоза и увеличении доли протеолитической микрофлоры указанные жирные кислоты начинают синтезироваться из белков преимущественно в виде изоформ, что отрицательно сказывается на состоянии толстой кишки, с одной стороны, и может быть диагностическим маркером — с другой.
Помимо этого, различные представители сапрофитной флоры имеют свои потребности в определенных нутриентах, объясняющиеся особенностями их метаболизма. Так, бифидобактерии расщепляют моно-, ди-, олиго- и полисахариды, используя их как энергетический и пластический субстрат. При этом они могут ферментировать белки, в том числе и для энергетических целей; не требовательны к поступлению с пищей большинства витаминов, но нуждаются в пантотенатах.
Лактобактерии также используют различные углеводы для энергетических и пластических целей, однако плохо расщепляют белки и жиры, поэтому нуждаются в поступлении извне аминокислот, жирных кислот, а также витаминов.
Энтеробактерии расщепляют углеводы с образованием углекислого газа, водорода и органических кислот. При этом существуют лактозонегативные и лактозопозитивные штаммы. Также они могут утилизировать белки и жиры, поэтому мало нуждаются во внешнем поступлении аминокислот, жирных кислот и большинства витаминов.
Очевидно, что питание сапрофитной микрофлоры и ее нормальное функционирование принципиально зависит от поступления к ней не переваренных углеводов (ди-, олиго- и полисахаридов) для энергетических целей, а также белков, аминокислот, пуринов и пиримидинов, жиров, углеводов, витаминов и минералов — для пластического обмена. Залогом поступления к бактериям необходимых нутриентов является рациональное питание макроорганизма и нормальное течение пищеварительных процессов.
Хотя моносахариды могут легко утилизироваться микроорганизмами толстой кишки, к пребиотикам их не относят.
В нормальных условиях кишечная микрофлора не потребляет моносахариды, которые должны полностью всасываться в тонкой кишке. Пребиотики включают некоторые дисахариды, олигосахариды, полисахариды и достаточно гетерогенную группу соединений, в которой присутствуют и поли- и олигосахариды, которую обозначили как пищевые волокна. Из пребиотиков в женском молоке присутствует лактоза и олигосахариды.
Лактоза (молочный сахар) представляет собой дисахарид, состоящий из галактозы и глюкозы. В норме лактоза расщепляется лактазой тонкой кишки до мономеров, которые практически полностью всасываются в тонкой кишке. Лишь незначительное количество нерасщепленной лактозы у детей первых месяцев жизни попадает в толстую кишку, где утилизируется микрофлорой, обеспечивая ее становление. В то же время дефицит лактазы приводит к избытку лактозы в толстой кишке и значительному нарушению состава кишечной микрофлоры и осмотической диарее.
Лактулоза — дисахарид, состоящий из галактозы и фруктозы, в молоке (женском или коровьем) отсутствует, однако в небольших количествах может образовываться при нагревании молока до температуры кипения. Лактулоза не переваривается ферментами ЖКТ, ферментируется лакто- и бифидобактериями и служит им субстратом для энергетического и пластического обмена, за счет чего способствует их росту и нормализации состава микрофлоры, увеличению объема биомассы в содержимом кишечника, что определяет ее слабительный эффект. Помимо этого, показана антикандидозная активность лактулозы и ее угнетающий эффект на сальмонелл. Полученная синтетическим путем лактулоза (дюфалак) широко используется как эффективное слабительное средство, обладающее пребиотическими свойствами. Как пребиотик детям дюфалак назначается в низких дозах, не оказывающих слабительного эффекта (по 1,5–2,5 мл 2 раза в день в течение 3–6 нед).
Олигосахариды представляют собой линейные полимеры глюкозы и других моносахаров с общей длиной цепи не более 10. По химической структуре выделяют галакто-, фрукто-, фукозил-олигосахариды и др. Концентрация олигосахаридов в женском молоке относительно невелика, не более 12–14 г/л, однако их пребиотический эффект весьма значителен. Именно олигосахариды сегодня рассматриваются как основные пребиотики женского молока, обеспечивающие как становление нормальной микрофлоры кишечника ребенка, так и ее поддержание в дальнейшем. Важным является то обстоятельство, что олигосахариды присутствуют в значимых концентрациях только в женском молоке и отсутствуют, в частности, в коровьем. Следовательно, в состав адаптированных молочных смесей для искусственного вскармливания здоровых детей должны добавляться пребиотики (галакто- и фруктосахариды).
Полисахариды представляют собой длинноцепочечные углеводы в основном растительного происхождения. Инулин, содержащий фруктозу, в больших количествах присутствует в артишоках, клубнях и корнях георгинов и одуванчиков; утилизируется бифидо- и лактобактериями, способствует их росту. Помимо этого, инулин повышает всасывание кальция и влияет на метаболизм липидов, снижая риск развития атеросклероза.
Пищевые волокна — большая гетерогенная группа полисахаридов, наиболее известными из которых являются целлюлоза и гемицеллюлоза. Целлюлоза — неразветвленный полимер глюкозы, а гемицеллюлоза — полимер глюкозы, арабинозы, глюкуроновой кислоты и ее метилового эфира. Помимо функции субстрата для питания лакто- и бифидофлоры и опосредованно поставщика короткоцепочечных жирных кислот для колоноцитов, пищевые волокна оказывают и другие важные эффекты. Они обладают высокой адсорбционной способностью и удерживают воду, что приводит к повышению осмотического давления в полости кишки, увеличению объема фекалий, ускорения пассажа по кишечнику, что обусловливает слабительный эффект.
В средних количествах (1–1,9 г/100 г продукта) пищевые волокна содержатся в моркови, сладком перце, петрушке (в корне и зелени), редьке, репе, тыкве, дыне, черносливе, цитрусовых, бруснике, фасоли, гречневой, перловой крупе, «Геркулесе», ржаном хлебе.
Высокое содержание (2–3 г/100 г продукта) пищевых волокон характерно для чеснока, клюквы, красной и черной смородины, черноплодной рябины, ежевики, овсяной крупы, хлеба из белково-отрубной муки.
Наибольшее же их количество (более 3 г/100 г) содержится в укропе, кураге, клубнике, малине, чае (4,5 г/100 г), овсяной муке (7,7 г/100 г), пшеничных отрубях (8,2 г/100 г), сушеном шиповнике (10 г/100 г), жареном кофе в зернах (12,8 г/100 г), овсяных отрубях (14 г/100 г). Пищевые волокна отсутствуют в рафинированных продуктах.
Несмотря на очевидную значимость пребиотиков для питания микрофлоры, благополучия ЖКТ и всего организма в целом, в современных условиях отмечается дефицит пребиотиков в питании во всех возрастных группах. В частности, взрослый человек должен съедать в сутки примерно 20–35 г пищевых волокон, тогда как в реальных условиях европеец потребляет не более 13 г в сутки. Уменьшение доли естественного вскармливания у детей первого года жизни приводит к недостатку пребиотиков, содержащихся в женском молоке.
Таким образом, пребиотики обеспечивают благополучие микрофлоры толстой кишки, здоровье толстой кишки и являются необходимым фактором здоровья человека в связи с их существенными метаболическими эффектами. Преодоление дефицита пребиотиков в современных условиях связано с обеспечением рационального питания лиц всех возрастных категорий, начиная от новорожденных и кончая людьми преклонного возраста.
Литература
- Ардатская М. Д., Минушкин О. Н., Иконников Н. С. Дисбактериоз кишечника: понятие, диагностические подходы и пути коррекции. Возможности и преимущества биохимического исследования кала: пособие для врачей. М., 2004. 57 с.
- Бельмер С. В., Гасилина Т. В. Рациональное питание и состав кишечной микрофлоры//Вопросы детской диетологии. 2003. Т. 1. № 5. С. 17–20.
- Доронин А. Ф., Шендеров Б. А. Функциональное питание. М.: ГРАНТЪ, 2002. 296 с.
- Конь И. Я. Углеводы: новые взгляды на их физиологические функции и роль в питании//Вопросы детской диетологии. 2005. Т. 3. № 1. С. 18–25.
- Boehm G., Fanaro S., Jelinek J., Stahl B., Marini A. Prebiotic concept for infant nutrition//Acta Paediatr Suppl. 2003; 91: 441: 64–67.
- Choi S. W., Friso S., Ghandour H., Bagley P. J., Selhub J., Mason J. B. Vitamin B12 deficiency induces anomalies of base substitution and methylation in the DNA of rat colonic epithelium//J. Nutr. 2004; 134 (4): 750–755.
- Edwards C. A., Parrett A. M. Intestinal flora during the first months of life: new perspectives//Br. J. Nutr. 2002; 1: 11–18.
- Fanaro S., Chierici R., Guerrini P., Vigi V. Intestinal microflora in early infancy: composition and development //Acta Paediatr. 2003; 91: 48–55.
- Hill M. J. Intestinal flora and endogenous vitamin synthesis//Eur. J. Cancer. Prev. 1997; 1: 43–45.
- Midtvedt A. C., Midtvedt T. Production of short chain fatty acids by the intestinal microflora during the first 2 years of human life//J. Pediatr. Gastroenterol. Nutr. 1992; 15: 4: 395–403.
С. В. Бельмер, доктор медицинских наук, профессор
А. В. Малкоч, кандидат медицинских наук
РГМУ, Москва
Приложения
-
- Кишечная микрофлора и значение пребиотиков для ее функционирования - Таблица 1
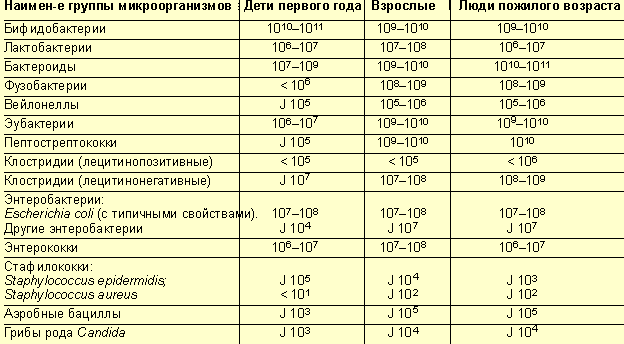
Возрастные аспекты состава кишечной микрофлоры
-
- Кишечная микрофлора и значение пребиотиков для ее функционирования - Таблица 2
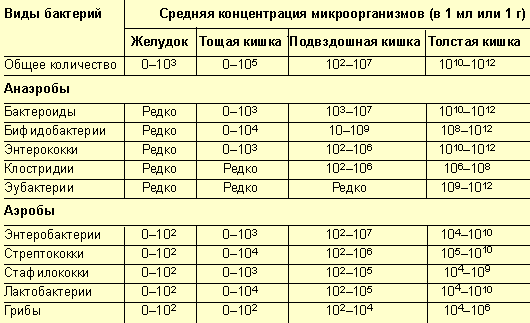
Состав микрофлоры у здоровых взрослых









