При терапии распространенных болевых синдромов (суставных, мышечных, болей в спине) пациенты часто занимаются самолечением. На выбор анальгетика оказывает влияние как опыт его использования самим пациентом, так и мнение, сформированное рекламой в средствах массовой информации, или же советы провизора в аптеке. Проблема рационального выбора осложняется большим числом зарегистрированных в России анальгетиков и нестероидных противовоспалительных препаратов (НПВП) — более 200 различных торговых наименований и огромное количество различных лекарственных форм [1]. Собственно проблема состоит в том, чтобы выбрать не только эффективный, но и безопасный препарат, что, как подтверждается повседневной практикой, осуществляется далеко не всегда. Все еще высоки продажи метамизола (анальгина) и метамизолсодержащих препаратов, запрещенных в большинстве стран из-за высокого риска токсического действия [2].
Среди получивших широкое распространение в нашей стране средств, обладающих анальгетической активностью, можно выделить парацетамол, ацетилсалициловую кислоту (АСК) и ибупрофен. Требования, предъявляемые к «идеальному» безрецептурному анальгетику, могут быть сформулированы следующим образом:
- наличие лекарственных форм для приема внутрь, которые быстро абсорбируются в желудке и кишечнике;
- быстрое создание пиковых концентраций в плазме крови;
- относительно короткий период полуэлиминации из плазмы крови (предупреждение кумуляции) и вместе с тем достаточно продолжительное действие;
- минимальный спектр побочных эффектов при эпизодическом и повторном приемах.
Для АСК характерны анальгетический, жаропонижающий и противовоспалительный эффекты. Кроме того, она препятствует агрегации тромбоцитов. Поэтому в ряде ситуаций, например при менструальных болях, болях после экстракции зуба, различных пункций, даже однократное применение АСК может увеличить или спровоцировать кровопотерю. Ибупрофен и парацетамол лишены антиагрегантных свойств, кроме того, для парацетамола не характерны лекарственные взаимодействия и он разрешен при «аспириновой» астме.
Анальгетические свойства объясняются сочетанием периферического и центрального компонентов действия препаратов. Центральный анальгетический эффект связан с их непосредственным влиянием на синтез простагландинов в головном и спинном мозге. Периферическое действие связано в основном с влиянием на циклооксигеназный путь превращений арахидоновой кислоты [3]. Существуют две формы циклооксигеназы — конституциональная (ЦОГ-1), в результате деятельности которой образуются «гомеостатические» простагландины (I2, Е2, тромбоксан А2), и индуцированная (ЦОГ-2), появляющаяся только при воспалении и также контролирующая синтез простагландинов, но «провоспалительных», поддерживающих воспаление [4]. Ингибированием ЦОГ-2 объясняется противовоспалительный эффект препаратов, в то время как при блокаде ЦОГ-1 возникает их побочное действие. Провоспалительные простагландины способны как напрямую стимулировать, так и вызывать десенситизацию первичных афферентных ноцицептивных волокон, причем эта гиперальгезия является ЦОГ-2-зависимым феноменом [5].
Известно, что парацетамол значительно более активен как антипростагландиновый препарат в головном и спинном мозге (что даже позволило высказать предположение о существовании третьей изоформы ЦОГ-3, к которой он тропен). В то же время на различных экспериментальных моделях показано и его периферическое действие. Салицилаты и ибупрофен эффективно подавляют воспаление в тканях при сохранении эффекта на нервную систему. Имеются доказательства их спинального антиноцицептивного эффекта через воздействие на опиодергическую систему [6].
Следует четко различать реальную и хорошо изученную опасность применения НПВП для лечения лихорадки и воспалительных процессов (курсовое, периодически повторяющееся применение), и однократного купирования боли, в том числе в домашних условиях. Их «анальгетические» дозы ниже, чем «противовоспалительные», и, безусловно, менее опасны для пациента. Исследования, в ходе которых осуществлялась раздельная оценка безопасности анальгетиков, показали, что парацетамол и ибупрофен переносятся одинаково хорошо — достоверно лучше, чем ацетилсалициловая кислота.
Безопасность анальгетиков, как и многих других лекарственных средств, определяется также особенностями метаболизма. Парацетамол метаболизируется в печени тремя путями: конъюгацией с глюкуронидами (60%), сульфатированием (35%) и биотрансформацией в системе ферментов цитохрома Р-450 (5%) [7]. Последний путь приводит к образованию парацетамоловых конъюгатов — производных цистеина и меркаптуровой кислоты. Они обладают гепато- и нефротоксичностью, что может представлять опасность, особенно у детей [8]. Это тем более актуально, что родители завышают дозы парацетамола в 40% случаев, желая получить более быстрый и продолжительный обезболивающий результат [9]. Одним из ранних признаков поражения печени считается повышение уровня альфа-фетопротеина в крови [10]. Следует отметить, что в случае передозировки токсичность парацетамола может быть выше, чем ибупрофена, поскольку быстро происходит насыщение ферментативных систем, разрушающих парацетамол, а разница между высшей терапевтической и минимальной токсической концентрациями у него меньше, чем у ибупрофена [11]. Не следует думать, что лекарственное поражение печени и почек возможно лишь при длительном приеме лекарств. Так, даже при краткосрочном лечении, в том числе и при самолечении, нетяжелых болевых синдромов, например, АСК может приводить к гепатитам, нарушению синтеза белков, регулирующих свертывание крови, и даже печеночной недостаточности [12].
Токсическое действие лекарства во многом зависит от его распределения в организме, оцениваемого по объему распределения (Vd), т. е. теоретическому объему, в котором вещество может быть одномоментно полностью растворено в жидкостях организма. Способность молекулы лекарственного вещества достичь ткани во многом зависит от степени его растворимости и связывания с белками плазмы крови. Оно легко диффундирует в ткани, если имеет высокий Vd, обладает высокой липофильностью и неионизировано. Vd рассматривается в сравнении с контрольным объемом 0,6 л/кг, что соответствует объему обменной воды, т. е. плазмы, интерстициальной жидкости и цитозольной воды. Если Vd ниже 0,1 л/кг, то это значит, что вещество не распределяется в ткани, действует в просвете кишечника. В диапазоне 0,1–0,6 л/кг лекарство выходит из плазменного компонента, проникает в интерстициальную жидкость, но не входит в клетки, превышение показателя Vd = 0,6 л/кг говорит о том, что вещество проникает в клетку и связывается с клеточными структурами. Это может быть причиной токсического, повреждающего действия на клетку. С этой точки зрения ибупрофен, имеющий Vd = 0,26 л/кг, потенциально менее цитотоксичен, чем парацетамол, у которого Vd = 0,62 л/кг [13, 14]. Возможно, именно этим объясняется его меньшая, чем у парацетамола, гепатотоксичность.
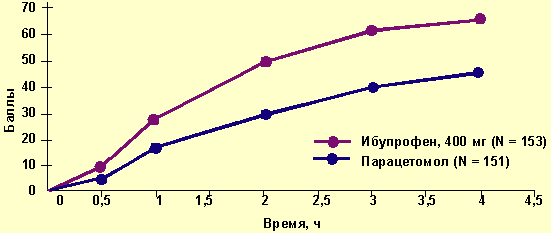
Установлено, что сопоставимое анальгетическое действие с 1000 мг парацетамола оказывает ибупрофен в дозе 400 мг. Биодоступность ибупрофена при приеме внутрь составляет 80–100%, максимальная концентрация препарата в крови отмечается через 0,5–1 ч после приема, 99% препарата связывается с белками крови. Период полуэлиминации ибупрофена составляет около 2 ч. Ибупрофен в дозе 400 мг превышает анальгетическую эффективность отдельных комбинированных анальгетиков и в указанной дозе обладает более благоприятным профилем безопасности по сравнению с АСК и парацетамолом. Одной из причин, по которой следует ограничивать терапию НПВП высокими дозами, остается эффект «насыщения» ферментативных систем печени, перерабатывающих лекарство [15]. В меньшей степени это относится к ибупрофену, для детоксикации которого не требуется участия всех компонентов системы микросомального окисления печени, а следовательно, всегда есть дополнительные резервы для метаболизации. Уровень ибупрофена в крови в зависимости от функционального состояния печени может колебаться в 40 (!) раз без повреждающего действия на органы и ткани [16]. В США ибупрофен при суставных хронических болях применяется более чем в половине случаев, когда требуется использование безрецептурных анальгетиков, при этом почти 44% пациентов постоянно превышают рекомендованные производителем суточные дозы, а частота нежелательных эффектов при таком приеме невысока [17]. И хотя мы, разумеется, не поддерживаем практику бесконтрольного приема и завышения дозировок, тем не менее нельзя не отметить, что эти данные подтверждают высокий индекс безопасности ибупрофена. Эпидемиологические данные подтверждают высокую эффективность разовой дозировки ибупрофена в 400 мг, которую и следует считать наиболее безопасной [18]. В сравнительном исследовании ибупрофен в дозе 400 мг при головной боли продемонстрировал равные анальгетические возможности с парацетамолом, применявшимся в большой дозировке — 1000 мг (рис.) [19]. Терапия ибупрофеном болевого синдрома в спине дает не только высокие клинические результаты, но и имеет ярко выраженные фармакоэкономические преимущества перед другими НПВП за счет малого числа осложнений [20]. Интересно отметить отсутствие значимой толерантности при повторных приемах ибупрофена, что позволяет применять его при хронических или упорно рецидивирующих болевых синдромах. Это, помимо суставных, могут быть периодические боли у женщин, хроническая зубная боль при периодонтитах, пародонтозе, боли в постоперационном периоде.
Таким образом, на основании вышесказанного можно сделать вывод, что продолжительный прием любого НПВП требует консультации врача и медицинского наблюдения.
Литература
- Регистрация лекарственных средств в РФ: переходит ли количество в качество?//Фармацевтический вестник. 2000. № 10. С. 6.
- consolidation list of products whose consumption and/or sale have been banned, withdrawn, severely restricted or not approved by governments. 6th Edition, UN, Genova, 1997.
- Carr D. B., Goudas L. C. Acute pain//Lancet. 1999; 353: 2051-2058.
- Vane J. R., Botting R. M. Overview: the mechanism of action of antiinflammatory drugs. Clinical significance and potential of selective COX-2 inhibitors. Ed. Vane J. R., Botting R. M. William Harvey Press, London, 1998; 1-18.
- Ferreira S. H. Blockade of inflammatory hyperalgesia and cyclooxygenase-2. In.: New targets in inflammation. Inhibitors of COX-2 or adhesion molecules. Ed. Bazan N., Botting J., Vane J. Kluwer. Acad. Press., 1996; 39-45.
- McCormack N. Non-steroidal anti-inflammatory drugs and spinal nociceptive processing//Pain. 1994; 59: 9-43.
- Ивашкин В. Т., Фисенко В. П., Шептулин А. А., Макарьянц М. Л. Актуальные вопросы безопасности ненаркотических анальгетиков//Клин. фармакология и терапия. 1999. Т. 8. № 5. С. 51-54.
- Запруднов А. М. Парацетамол в педиатрической практике М.: Стерлинг Хелс, 1994. С. 26-52.
- Simon H. K., Weinkle D. A. Over-the-counter medications. Do parents give what they intend to give? // Arch. Pediatr. Adolesc. Med. 1997; 151: 7: 654-656.
- Schmidt L. E., Dalhoff K. Alpha-fetoprotein is a predictor of outcome in acetaminophen-induced liver injury//Hepatology. 2005; 41: 1: 26-31.
- Volans G., Monaghan J., Colbridge M. Ibuprofen overdose//Int. J. Clin. Pract. Suppl. 2003; 135: 54-60.
- Speeg K. V. OTC analgesic use in people who consume alcohol // OTC analgesic use. Special report. 1996; 53-55.
- Chyka Р. А., Holley J. E., Mandrell T. D., Sugathan P. Correlation of drug pharmacokinetics and effectiveness of multiple-dose activated charcoal therapy// Annals Emerg. Med. 1995; 25: 3: 356-362.
- Scott S. C. The pharmacokinetics of ibuprofen suspension, chewable tablets, and tablets in children with cystic fibrosis//J. Pediatr. 1999; 134: 1: 58-63.
- MacPherson R. D. New directions in pain management//Drugs Today. 2002; 38: 2: 135-145.
- Wang P., Qi M., Liu L., Fang L. Determination of ibuprofen in dog plasma by liquid chromatography and application in pharmacokinetic studies of an ibuprofen prodrug in dogs//J. Pharm. Biomed. Anal. 2005; 38: 4: 714-719.
- Wilcox C. M., Cryer B., Triadafilopoulos G. Patterns of use and public perception of over-the-counter pain relievers: focus on nonsteroidal antiinflammatory drugs // J. Rheumatol. 2005; 32: 11: 2218-2224.
- Sachs C. Oral analgesics for acute nonspecific pain//Am. Fam. Physician. 2005; 71: 913-918.
- Schachtel B. P., Furey S. A., Thoden W. R. Nonprescription ibuprofen and acetaminophen in the treatment of tension-type headache//J. Clin. Pharmacol. 1996; 36: 12: 1120-1125.
- Lloyd A., Scott D. A., Akehurst R. L. et al. Cost-effectiveness of low-level heat wrap therapy for low back pain//Value Health. 2004; 7: 4: 413-422.
О. И. Карпов, доктор медицинских наук, профессор
СПб ГМУ им. И. П. Павлова, Санкт-Петербург
Приложения
-
- Анальгетические эффекты нестероидных противовоспалительных препаратов - Рисунок. Эффективность ибупрофена в сравнении с парацетамолом при головной боли