Хроническая надпочечниковая недостаточность (ХНН) — клинический синдром, обусловленный недостаточным содержанием гормонов коры надпочечников, в результате нарушения функционирования одного или нескольких звеньев гипоталамо-гипофизарно-надпочечниковой системы.
Классификация надпочечниковой недостаточности
Первичная надпочечниковая недостаточность
- Аутоиммунная деструкция коры надпочечников:
- изолированная первичная надпочечниковая недостаточность;
- аутоиммунный полигландулярный синдром 1 типа;
- аутоиммунный полигландулярный синдром 2 типа.
- Туберкулез надпочечников.
- Адренолейкодистрофия.
- Ятрогенная первичная надпочечниковая недостаточность (двусторонняя адреналэктомия).
- Метастатическое и опухолевое поражение надпочечников.
- Геморрагический инфаркт надпочечников (ДВС-синдром, синдром Уотерхауса-Фридериксена).
- Редко встречающиеся причины: амилоидоз, грибковые инфекции, сифилис, ВИЧ-ассоциированный комплекс.
Центральная (гипоталамо-гипофизарная) надпочечниковая недостаточность
Вторичная надпочечниковая недостаточность
- Терапия препаратами глюкокортикоидов.
- В рамках гипопитуитаризма.
- Изолированный дефицит АКТГ.
Третичная надпочечниковая недостаточность (повреждения гипоталамуса различного генеза)
Классическое описание первичной хронической надпочечниковой недостаточности было сделано Томасом Аддисоном в 1855 г., тогда как проведение эффективной заместительной терапии заболевания оказалось возможным только в 30-х гг. ХХ в. Первая попытка лечения больных экстрактом надпочечников, который назначался внутрь, была предпринята R. Stockman в 1867 г. и оказалась неудачной. В 1936 г. E. C. Kendall et al. впервые получили из экстракта коры надпочечников кортикостерон и дегидрокортикостерон в кристаллической форме, а в 1937 г. M. von Steiger и T. Reichstein выделили дезоксикортикостерона ацетат (ДОКСА) и синтезировали его из сигмастерола. С 1939 г. ДОКСА в виде внутримышечных инъекций начали с успехом использовать в лечении первичной хронической надпочечниковой недостаточности. В середине 70-х гг. ДОКСА применялся в виде подкожных подсадок кристаллов по 100 мг, что избавляло пациента от необходимости делать инъекции. Однако это затрудняло подбор дозировки из-за индивидуальной скорости всасывания препарата и невозможности регулирования его действия при нестабильном АД, а сама манипуляция подсадки требовала специальной квалификации персонала. В 1953 г. Freed и Sabo синтезировали пероральный минералокортикоид 9α-фторкортизол (кортинефф), который с тех пор широко используется во всем мире и в конце 70-х гг. пришел на смену препарату ДОКСА, применявшемуся до этого в России [2].
Современная заместительная терапия первичной хронической надпочечниковой недостаточности заключается в обязательном комбинированном назначении препаратов глюко- и минералокортикоидов. Типичной ошибкой является лечение первичной хронической надпочечниковой недостаточности с помощью монотерапии глюкокортикоидами. Часто в этой ситуации, несмотря на увеличение дозы препарата, состояние больных не нормализуется, а дозировки продолжают увеличивать, что в ряде случаев приводит к развитию экзогенного синдрома Кушинга [1, 3].
По данным Нидерландского исследования (P. M. J. Zelissen, 1994), назначение монотерапии глюкокортикоидами можно считать обоснованным не более чем в 6,6% случаев, при этом следует учитывать, что практически все обследованные пациенты получали таблетированный гидрокортизон или кортизон-ацетат, который обладает большей минералокортикоидной активностью, чем синтетические глюкокортикоиды.
При вторичной надпочечниковой недостаточности дефицит минералокортикоидов не наблюдается, и в назначении минералокортикоидов (кортинефф) необходимости, как правило, нет, за исключением тех случаев, когда у пациента имеется выраженная артериальная гипотензия [5].
Заместительная терапия первичной хронической надпочечниковой недостаточности минералокортикоидами подразумевает использование только одного препарата — 9α-фторкортизола (9α-FF, кортинефф). Естественный минералокортикоид альдостерон не назначается для заместительной терапии по той же причине, что и ДОКСА, — из-за полной метаболизации при первом прохождении через печень; кроме того, препарат чистого альдостерона стоит достаточно дорого.
Основные преимущества 9α-FF заключаются в его эффективности при пероральном применении, а также в минералокортикоидной активности. После приема внутрь препарат быстро и полностью всасывается из желудочно-кишечного тракта. Своего пика плазменная концентрация 9α-FF достигает через 1,5 ч после приема. Период полувыведения составляет 18—36 ч, что позволяет имитировать практически не имеющую циркадного ритма секрецию альдостерона, благодаря ежедневному однократному приему 0,05—0,2 мг препарата. Метаболизируется 9α-FF в печени, выделяется с мочой в виде неактивных метаболитов. Интересен тот факт, что, как и сам альдостерон, кортизол и 9α-FF имеют одинаковую аффинность к рецепторам альдостерона в почках. Однако если альдостерон и 9α-FF достигают рецептора, то кортизол, попав в клетку, в результате действия 11-b-гидроксистероиддегидрогеназы превращается в неактивный кортизон. Именно поэтому минералокортикоидная активность 9α-FF в 200—400 раз выше, чем у кортизола, хотя эти соединения отличаются друг от друга всего на один атом фтора, который делает 9α-FF неуязвимым для указанного фермента. Глюкокортикоидными эффектами 9α-FF на практике можно пренебречь, поскольку ощутимо они проявляются, если доза препарата превышает 0,5 мг/сут. Глюкокортикоидный эффект 1мг 9α-FF (10 таблеток кортинеффа) эквивалентен 20 мг гидрокортизона.
Фармакологическое действие кортинеффа заключается в воздействии на дистальную часть почечных канальцев, усилении обратного всасывания ионов натрия и воды, а также увеличении выделения ионов калия и водорода. Кортинефф влияет также на выделение воды и электролитов толстым кишечником, потовыми и слюнными железами. Увеличение объема внеклеточной жидкости и задержка натрия в организме приводят к повышению АД. При длительном применении кортинеффа повышение АД связано с увеличением периферического сопротивления, а не только с его влиянием на водно-электролитный обмен [3].
Кортинефф в дозах, превышающих терапевтические, может угнетать функцию коры надпочечников, у молодых пациентов — функцию вилочковой железы, тормозить секрецию АКТГ гипофизом, а также ускорять процесс отложения гликогена в печени, а при недостаточном количестве белка в пище приводить к отрицательному азотистому балансу. По данным литературы, частым симптомом передозировки 9α-FF являются отеки, которые, как правило, не сопровождаются значительным подъемом АД у пациентов с первичной ХНН. Отечность на фоне терапии носит преходящий характер, развиваясь при первом назначении или увеличении дозы препарата.
Кортинефф назначается один раз в сутки в дозе 0,05—0,1 мг (максимально 0,2 мг), ежедневно утром, после еды, его необходимо запивать большим количеством жидкости. В ряде случаев дозу 9α-FF приходится увеличивать летом, особенно в условиях жаркого климата, что связано с повышением потерь натрия и воды, выводящихся из организма с потом.
Если имел место пропуск приема препарата, следует принять его как можно быстрее. Если же приближается время следующего приема, пропущенную дозу нужно отменить. При необходимости доза препарата уменьшается постепенно. Во время терапии кортинеффом не следует проводить вакцинацию. Препарат может маскировать проявление симптомов инфекционно-воспалительных заболеваний. На фоне применения кортинеффа в высоких дозах обязательно определение концентрации электролитов в плазме крови (Na, K) [4].
На сегодняшний день разработаны следующие критерии адекватности минералокортикоидного компонента заместительной терапии первичной ХНН [1, 3]:
- нормальные уровни калия и натрия плазмы;
- нормальное (комфортное) артериальное давление;
- отсутствие отечности, задержки жидкости (признаки передозировки препарата);
- нормальный или умеренно повышенный уровень активности ренина плазмы (АРП).
Как показало исследование M. Jadoul et al. (1991), артериальное давление при первичной ХНН коррелирует с АРП (см. рисунок) и, таким образом, с дозой 9α-FF. Следовательно, первым шагом в лечении артериальной гипертензии у больных первичной ХНН является ограничение потребления пищевой соли в сочетании с уменьшением дозы 9α-FF. Назначение диуретиков и спиронолактона вместе с кортинеффом не оправдано, поскольку эти препараты действуют как антагонисты [5].
| Воздействие ренин-ангиотензин-альдостерон системы на артериальное давление |
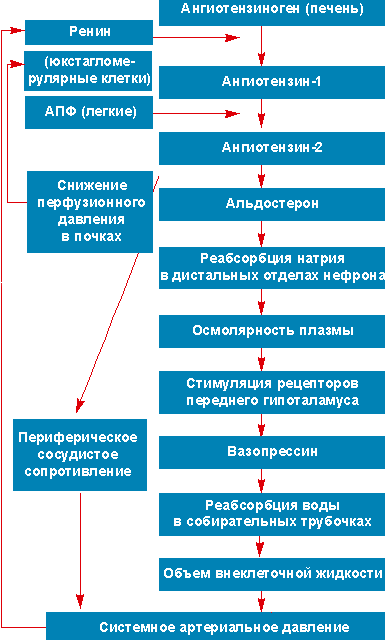 |
Нами был составлен регистр больных с ХНН г. Москвы. Из 300 человек минералокортикоиды были назначены 180 (60%). Большая часть пациентов, принимающих кортинефф, имеют первичную ХНН аутоиммунной природы или развившуюся вследствие оперативного вмешательства. Относительно низкий процент использования минералокортикоидов свидетельствует о недостаточной информированности врачей различных лечебных учреждений г. Москвы о современных подходах к заместительной терапии первичной ХНН. Доза кортинеффа составляла от 0,1 до 0,2 мг и принималась однократно утром. Побочных эффектов (подъемы АД и задержка жидкости) не наблюдалось.
Следует отметить некоторые особенности заместительной терапии кортинеффом во время беременности. При беременности происходит постепенное и значительное увеличение уровня прогестерона, который является антагонистом минералокортикоидов. Поэтому необходимая доза 9α-FF в этот период может значительно возрастать. Подбор дозы должен осуществляться по уровню калия плазмы и артериальному давлению. Уровень АРП неинформативен, поскольку во время беременности он и в норме значительно повышен. Описаны случаи, когда, основываясь на перечисленных критериях, дозу 9α-FF приходилось увеличивать до 0,3 и даже до 0,6 мг в день (S. Diederich et al., 1994).
Дети, рожденные от матерей, получавших 9α-FF, требуют тщательного медицинского наблюдения из-за опасности развития у них недостаточности функции надпочечников. При назначении препарата женщине в период кормления грудью следует решить вопрос о переводе ребенка на искусственное вскармливание [2, 5].
Надпочечниковая недостаточность представляет собой одну из самых серьезных по своим проявлениям и осложнениям эндокринопатий. Больных с хронической надпочечниковой недостаточностью необходимо обследовать два раза в год. Следует подчеркнуть, что для оценки эффективности заместительной терапии решающую роль имеют клинические данные. Не следует добиваться оптимальных лабораторных показателей за счет назначения высоких доз глюко- и минералокортикоидов, что может привести к передозировке и клиническим симптомам гиперкортицизма. В условиях заместительной терапии прогноз заболевания будет зависеть от ее адекватности, что делает обязательным обучение пациентов приемам самоконтроля и наблюдение за ними в специализированном лечебном учреждении.
По вопросам литературы обращайтесь в редакцию
Г. А. Мельниченко, доктор медицинских наук, профессор
Г. Ф. Александрова, кандидат медицинских наук
М. Б. Анциферов, доктор медицинских наук, профессор
Т. С. Елисеева, С. Ф. Машков
ГУ ЭНЦ, Диабетологический центр РАМН, Москва









