Муковисцидоз (МВ) (Cystic Fibrosis) — наиболее частая наследственная патология, характеризующаяся мультисистемным поражением, обусловленным мутацией гена МВТР (муковисцидозного трансмембранного регулятора проводимости), вызывающей нарушение транспорта ионов хлора, натрия и бикарбонатов в эпителиальных клетках, что приводит к прогрессирующему повреждению экзокринных желез жизненно важных органов.
Хроническая респираторная инфекция, формирующаяся на основе генетического дефекта уже в первые годы жизни, является ведущим фактором, определяющим прогноз заболевания. Микробиология инфекций существенно отличается от таковых у пациентов без МВ. Наиболее значимыми патогенами являются Staphylococcus aureus, Pseudomonas аeruginosa, Burkholderia cepacia, Stenotrophomonas maltophilia, грибы, атипичные микобактерии, в то время как Streptococcus pneumoniae, Haemophilus influenzae и Moraxella catarrhalis, которые часто обнаруживаются при других заболеваниях лeгких, при МВ встречаются значительно реже. Каждый патоген способен вызвать воспаление, которое может привести к повреждению дыхательных путей, снижению лeгочной функции, ухудшению клинического статуса. Многие пациенты с МВ с раннего возраста инфицированы St. aureus, что требует проведения курсов антистафилококковой терапии, способных обеспечить эрадикацию патогена. Ранняя агрессивная терапия при первичном высеве Ps. aeruginosa позволяет отсрочить, а в некоторых случаях предотвратить развитие хронической синегнойной инфекции [1, 2, 3, 4, 5], поддерживающая терапия которой требует значительно больших финансовых затрат, нежели ранняя эрадикация синегнойной палочки.
С течением времени эпидемиологические показатели патогенов претерпевают изменения в силу увеличения продолжительности жизни больных, агрессивной и пролонгированной антибиотикотерапии, появления новых антибактериальных препаратов с ингаляционным методом введения, модификации микробиологических свойств самих бактерий. Проведение антимикробной терапии требует всe более серьeзной бактериологической и клинической оценки. В этой связи микробиологический мониторинг является определяющим для своевременного и оптимального подбора антибактериальной терапии, способной стабилизировать, а порой и улучшить падение лeгочной функции, которая является наиболее информативным маркeром выживаемости [2].
Цель исследования: сравнить состав микрофлоры у 38 больных МВ Ярославского региона в 2000 и 2008 годах и проследить его динамику за последние 4 года (30 пациентов) с изменением уровня резистентности основных патогенов к антибактериальным препаратам под влиянием антимикробной терапии.
Материалы и методы. Проведен сравнительный анализ бактериальной флоры у 38 больных МВ в 2000 и 2008 годах и бактериологический мониторинг 30 пациентов (возраст от 4 месяцев до 22 лет) с МВ (1048 изолятов) с 2005 по 2008 год. Исследовались образцы мокроты с предварительной оценкой еe адекватности (выявление нейтрофилов и сквамозных эпителиальных клеток) или, при еe отсутствии, смывы из глубоких отделов глотки, которые считаются высокоинформативными у пациентов без экспекторации мокроты [8]. Бактериологическое исследование проводилось при каждом рутинном визите, не реже 1 раза в 3 месяца, а также во время антибактериальной терапии инфекции, обусловленной Ps. aeruginosa, до и после лечения.
Были выделены группы больных (8) с хронической синегнойной инфекцией и пациенты с первичным (6) и интермиттирующим высевом Ps. aeruginosa (4). Согласно международным рекомендациям, о хронической инфекции Ps. aeruginosa можно судить при идентификации патогена в течение минимум 6 месяцев, подтверждeнной позитивными культурами (тремя и более) с прямыми (температура, интоксикация и т. д.) или непрямыми (уровень специфических антител) признаками инфекции и повреждения тканей. С учeтом ограниченных возможностей определения уровня антител к Ps. aeruginosa с практической точки зрения более приемлемыми являются критерии, предложенные Lee et al. в 2003 году [6], которыми мы и пользуемся в своей работе. В соответствии с этими критериями, обнаружение Ps. aeruginosa более чем в 50% образцов мокроты или смывов в течение предшествующих 12 месяцев есть не что иное, как хроническая инфекция Ps. aeruginosa. В случае высева синегнойной палочки менее чем из 50% образцов мокроты и орофаренгиальных смывов ситуация расценивалась как интермиттирующая инфекция (4). Пациенты с хронической синегнойной инфекцией получали плановые внутривенные курсы антисинегнойных препаратов 3–4 раза в год. Использовались сочетания цефалоспоринов III поколения (цефтазидим, цефепим, цефоперазон/сульбактам) или карбапенемов (имипенем) с аминогликозидами (амикацин). Больные с первичным высевом Ps. aeruginosa получали курс в/в антибактериальной терапии в течение 14 дней с последующим 3-недельным приeмом перорального ципрофлоксацина в сочетании с ингаляциями гентамицина. C 2008 года больные с первичным и интермиттирующим высевом патогена получали эрадикационную терапию ингаляционным колистиметатом натрия и/или пероральным ципрофлоксацином в течение трех месяцев. Все пациенты получали базисную терапию микросферическими ферментами, ацетилцистеин, урсодезоксихолиевую кислоту, витамины, ежедневную кинезитерапию.
С 2006 года в состав базисного лечения включена рекомбинантная человеческая ДНаза (дорназа альфа, Пульмозим), улучшающая реологию мокроты за счeт фрагментации длинных цепей ДНК, высокая концентрация которых является основным фактором накопления патологически вязкого бронхиального секрета [3]. Использование Пульмозима в качестве базисного препарата обосновано ещe и доказанным противовоспалительным и антибактериальным эффектами. Снижение обсемененности мокроты St. aureus и Ps. аeruginosa [1, 4, 10] позволяет сократить количество дней внутривенной антибиотикотерапии, улучшить показатели функции внешнего дыхания [10]. Эти данные, а также отсутствие в течение трех лет нежелательных явлений при использовании препарата позволили применить дорназу альфа у детей с появлением первых признаков заинтересованности респираторного тракта, в т. ч. выявленных в процессе неонатального скрининга.
Проведeн сравнительный анализ динамики резистентности Ps. aeruginosa к антибактериальным препаратам за период с 2005 по 2008 год в зависимости от инфекционного диагноза (первичный высев, хроническая синегнойная инфекция).
Профиль бактериальной чувствительности и резистентности определялся с помощью дискодиффузионного метода с получением результата в соответствии с установленными контрольными точками, согласно рекомендациям Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute — CLSI).
Статистический анализ проводился с использованием программного обеспечения базы данных микробиологической лаборатории WOHNET 5, разработанной Центром по сотрудничеству с ВОЗ по контролю за резистентностью к антимикробным препаратам.
Результаты. Ведущими микроорганизмами, вызывающими хронический бронхолeгочный процесс, являются St. aureus, Ps. aeruginosa и другие неферментирующие грамотрицательные микроорганизмы.
Сравнение микробиологического статуса пациентов в 2000 и 2008 году свидетельствует об уменьшении доли St. aureus (с 52% до 43,7%) в структуре патогенов и роста высева изолятов неферментирующей грамотрицательной микрофлоры (НФГОМ) и, прежде всего, Ps. aeruginosа (рис. 1). Высев Ps. aeruginosa составил 42,1% всех полученных микроорганизмов. Причeм 2,6% штаммов были представлены мукоидными формами, в 19,8% случаев (28) Ps. aeruginosa высевалась в комбинации со St. аureus. У 5 пациентов в мокроте обнаружено по два различных морфотипа, различающихся по чувствительности к антибиотикам.
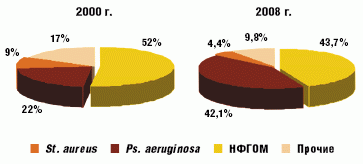
С 2000 года идентификация Ps. aeruginosa имела место у 22 (57,9%) из 38 наблюдаемых пациентов. Впервые колонизация синегнойной палочки обнаруживалась у больных в возрасте от 1,2 до 17 лет (средний возраст 10,4 года). На сегодняшний день о хронической синегнойной инфекции можно говорить в 8 случаях, у 6 больных высев Ps. аeruginosa носит интермиттирующий характер, у 4 пациентов Ps. аeruginosa обнаружена впервые.
С внедрением современных идентификационных систем (BBL Cristal) улучшилась идентификация НФГОМ. Появилась возможность дифференцировать другие виды псевдомонад (Ps. putida (10,6%), Ps. fluoreszens (1,2%)), B. cepacia (4,7%), S. maltophilia (3,5%), Ac. baumannii (1,2%) (рис. 2).
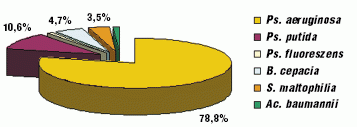
За 2005–2008 годы высев B. cepacia у всех больных (10) можно расценивать как интермиттирующий. Колонизация патогена не зависела от тяжести течения бронхолeгочного процесса. Ни в одном случае B. cepacia не оказала значимого влияния на частоту обострений, показатели лeгочной функции. У одного пациента высев B. cepacia неоднократно отмечался сразу после курсов в/в инфузий антисинегнойных препаратов, с последующим подавлением еe роста на фоне ингаляционной терапии тиамфениколом. Также эпизодически за этот период времени у 10 пациентов наблюдалась идентификация S. maltophilia, не оказывая существенного влияния на клинико-функциональные показатели.
Хроническая инфекция респираторного тракта, обусловленная ассоциацией Ac. baumannii и МRSA, явилась причиной гибели больного 22 лет с тяжeлым поражением лeгких.
Антибактериальная резистентность патогенов с течением времени также претерпевает существенные изменения.
В 2008 году из 80 изолятов St. aureus 8,85% (7) демонстрировали резистентность к оксациллину. Из 77 штаммов Ps. aeruginosa лишь 36,4% (28) были чувствительны ко всем препаратам, 15,6% (12) оказались панрезистентными. Из четырех изолятов B. cepacia два штамма продемонстрировали чувствительность к цефтазидиму, один — к меропенему, но два других оказались резистентны ко всем антибиотикам.
Чувствительность синегнойной палочки существенно различается при первичном высеве и у больных с хронической инфекцией, обусловленной Ps. aeruginosa.
У 10 пациентов с первичным высевом Ps. aeruginosa за 2007–2008 годы в 70% была высокочувствительна ко всем препаратам, что свидетельствует о высокой вероятности приобретения патогена из источников окружающей среды, а не от пациентов. У трех больных Ps. aeruginosa была резистентна к двум и более антибиотикам. В данном случае источником инфекции, скорее всего, являются больные муковисцидозом. Высокая вероятность внутрибольничного инфицирования подтверждается существенным преобладанием частоты и длительности предшествующего пребывания этих больных в пульмонологическом стационаре, по сравнению с детьми, которые при первичной изоляции Ps. aeruginosa имели высокочувствительные штаммы (табл. 1).

Несмотря на агрессивную антибактериальную терапию в/в антисинегнойными препаратами, эрадикации на срок 1 года и более удалось добиться только у четырeх больных (40%) с высокочувствительными штаммами. В остальных случаях повторный высев патогена отмечался в среднем через 7 месяцев после окончания эрадикационной терапии. При повторном высеве Ps. aeruginosa у 2 больных отмечалось двукратное нарастание уровня резистентности к антибактериальным препаратам. У одного пациента резистентный штамм сменился на чувствительный, что, скорее всего, обусловлено успешной эрадикацией и повторным инфицированием «диким» штаммом.
У больных с хронической синегнойной инфекцией (8) Ps. aeruginosa демонстрирует рост резистентности к антибактериальным препаратам (табл. 2). Комбинации цефтазидима, цефоперазона/сульбактама с амикацином являются наиболее часто используемыми. Однако нарастание резистентности отмечается в отношении всех изучаемых антибиотиков, в т. ч. и к препаратам, которые в течение последних 4 лет практически не применялись. Это касается в равной степени как пенициллинов, цефалоспоринов III поколония, так и карбапенемов. Использование ингаляционных гентамицина и колистиметата натрия не оказало влияния на рост к ним резистентности микроорганизмов. Выявленная более высокая резистентность немукоидных изолятов в сравнении с мукоидными остаeтся недостаточно понятной.
При динамическом мониторинге резистентности Ps. aeruginosa у одного и того же больного с хронической инфекцией в процессе плановой антибактериальной терапии не раз отмечалось нарастание резистентности Ps. aeruginosa к антибиотикам после 2-недельного курса в/в лечения с последующим восстановлением чувствительности микроорганизмов к последующему курсу через 3–4 месяца (феномен «адаптивной резистентности»).
Снижение плотности Ps. aeruginosa в образцах мокроты после проведения в/в антибактериальной терапии было связано с улучшением лeгочной функции. Однако у половины больных, несмотря на улучшение клинико-функциональных показателей, изменения в количестве колоний из образцов мокроты отсутствовали. Во всех случаях патогены, резистентные к антибиотикам in vitro, in vivo, оказывались эффективными при использовании их в комбинации.
Обсуждение. Восьмилетний бактериологический мониторинг больных МВ, наблюдаемых в региональном центре, свидетельствует об изменении бактериологического статуса пациентов в сторону увеличения высева синегнойной палочки и других неферментирующих грамотрицательных микроорганизмов. С одной стороны, это связано с увеличением продолжительности жизни больных, с другой, с улучшением диагностических возможностей региональных лабораторий. У больных с хронической синегнойной инфекцией отмечается высокий уровень резистентности Ps. aeruginosa в связи с массивной и пролонгированной антибактериальной терапией. Агрессивная эрадикационная терапия, используемая при первичном высеве патогена, не оказывает значимого влияния на чувствительность штаммов, полученных при повторном высеве микроба. Не исключено, что второй высев обусловлен колонизацией нового штамма. Эти данные согласуются с результатами 10-летнего ретроспективного анализа антибактериальной резистентности повторных изолятов Ps. aeruginosa у больных после успешно проведeнной интенсивной эрадикационной терапии, представленными Sheng-Ang Ho и Tim W. R. Lee (UK) с соавт. [6]. Они показали, что агрессивные режимы антибактериальной терапии при первичном высеве Ps. aeruginosa не оказали значимого влияния на рост резистентности штаммов, идентифицированных в последующем. В этом исследовании также не проводилось генетической идентификации штаммов, что позволяет предположить успешную первичную эрадикацию и повторную колонизацию новым патогенном. В работе Pitt c соавт. [7], где изучался генотип Ps. aeruginosa, наоборот, был показан высокий уровень резистентности к наиболее часто используемым антибактериальным препаратам как у больных с впервые выявленной инфекцией, так и при хроническом еe течении.
Прослеживается зависимость антибактериальной резистентности от источника инфицирования, длительности колонизации в дыхательных путях, антибактериальной стратегии. Высокая чувствительность штаммов при первичном высеве Ps. aeruginosa с высокой степенью вероятности позволяет предполагать колонизацию внешнесредовых микроорганизмов, в отличие от хронически инфицированных пациентов, у которых резистентность возрастает с течением времени и объeмом проводимой антисинегнойной терапии. Прямая корреляция резистентных штаммов Ps. aeruginosa, обнаруженных у больных при первичном высеве, с частотой и длительностью пребывания в условиях стационара лишний раз убеждает в необходимости более взвешенного подхода к терапии пациентов с колонизацией St. aureus и определения показаний к госпитализации. В связи с отсутствием селективных антистафилококковых препаратов (флуклоксациллин) лечение больных с хронической колонизацией St. aureus целесообразно ограничить лечением обострений и другой респираторной суперинфекции. В противном случае возрастает риск колонизации синегнойной палочки и другой НФГОМ [2, 4, 5].
Заключение. На сегодняшний день эффективная терапия инфекции дыхательных путей у больных МВ невозможна без проведения микробиологического мониторинга мокроты или орофаренгиального аспирата с определением чувствительности и резистентности патогенов к антибактериальным препаратам. Бактериологический контроль способствует своевременному выявлению колонизации новых микроорганизмов и проведению ранней эрадикационной терапии. При отсутствии в рутинной практике возможности определения уровня специфических антител к различным морфотипам Ps. aeruginosa микробиологический мониторинг является единственным инструментом идентификации хронической синегнойной инфекции, требующей пересмотра антибактериальной стратегии.
Определение уровня резистентности микроорганизмов способствует адекватному подбору антибактериальных препаратов в соответствии с разработанными протоколами лечения. Кроме того, бактериологический мониторинг является чрезвычайно важным для контроля изменений микробиологического статуса пациентов и необходимости проведения своевременных мероприятий по профилактике перекрeстного инфицирования, строгого соблюдения стандартов гигиены.
По вопросам литературы обращайтесь в редакцию.
И. К. Ашерова, кандидат медицинских наук
О. Ю. Верина
Е. Н. Медведева
Центр помощи больным муковисцидозом,
МУЗ Детская клиническая больница №1, Ярославль
Таблица 2. Частота применения и уровень резистентности Ps. aeruginosa к антибиотикам
Купить номер с этой статьей в pdf
.jpg)
.jpg)
.jpg)









