Всовременных рекомендациях по диагностике и лечению артериальной гипертензии (АГ) основная цель лечения определена как достижение максимального снижения долгосрочного риска сердечно-сосудистых осложнений (ССО). Достичь этой цели возможно как за счет снижения повышенного артериального давления (АД), так и путем коррекции сопутствующих факторов риска. У всех пациентов с АГ следует снижать АД по меньшей мере до уровня 140/90 мм рт. ст. и ниже при хорошей переносимости.
В настоящее время основной концепцией антигипертензивной терапии является органопротекция, которая предполагает, с одной стороны, защиту органов-мишеней от повреждений, с другой — восстановление уже имеющихся в них структурных и функциональных изменений.
Если говорить о сердце как органе-мишени, то последствиями негативного воздействия на него повышенного АД являются гипертрофия миокарда левого желудочка (ЛЖ), развитие фиброза, различные варианты ремоделирования, апоптоз, что в конечном итоге повышает риск развития ССО.
На ранних стадиях артериальной гипертонии развитие гипертрофии миокарда является результатом структурной адаптации ЛЖ к повышенной нагрузке давлением. По результатам Фремингемского исследования эхокардиографические признаки гипертрофии миокарда ЛЖ были отмечены у 5–49% женщин и у 8–33% мужчин в возрасте от 30 до 70 лет. Степень гипертрофии ЛЖ определяют наследственные и конституциональные факторы (пол, возраст), факторы питания (избыточный вес, чувствительность к соли), а также состояние симпатической нервной и ренин-ангиотензин-альдостероновой (РААС) систем. Результаты многочисленных клинических исследований показали, что гипертрофия миокарда является независимым фактором риска развития ССО, таких как стенокардия напряжения, аритмия, инфаркт миокарда и сердечная недостаточность.
Гипертрофия миокарда ЛЖ (ГМЛЖ) приводит к нарушению функциональных свойств миокарда, причем в первую очередь нарушается его диастолическое наполнение, а затем и систолическая функция. При ГМЛЖ нарушается коронарное кровообращение, что проявляется снижением коронарного резерва и недостаточной перфузией субэндокардиальных слоев миокарда. При наличии ГМЛЖ частота желудочковых аритмий также повышается.
Риск развития коронарной недостаточности, желудочковых нарушений ритма сердца при увеличении массы миокарда левого желудочка на 50% возрастает по меньшей мере вдвое.
Было отмечено, что в группе с выраженной гипертрофией ЛЖ риск сердечной недостаточности возрастает в 5 раз. У 30–40% больных с признаками сердечной недостаточности отмечается нормальное состояние систолической функции, т. к. на ранних стадиях гипертрофического ремоделирования возникают прежде всего нарушения диастолического наполнения ЛЖ и признаки диастолической дисфункции. Таким образом, у больных АГ диастолическая дисфункция является самостоятельным фактором развития сердечной недостаточности. Говоря о кардиопротективных свойствах лекарственных средств (ЛС), мы в первую очередь оцениваем их влияние на ГМЛЖ.
Ретроспективный анализ клинических исследований показал, что антигипертензивная терапия, уменьшающая ГМЛЖ, позволяет добиться снижения риска ССО.
К чему приведет снижение массы миокарда ЛЖ в результате приема антигипертензивных ЛС? В настоящее время доказано, что регресс ГМЛЖ сопровождается улучшением систолической функции, уменьшением миокардиального фиброза и улучшением диастолической функции ЛЖ, увеличением коронарного резерва, нормализацией локальной нервной системы и уменьшением аритмий, что в конечном счете может снизить риск ССО и улучшить прогноз (рис. 1).
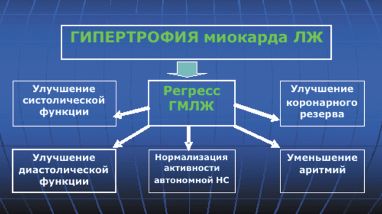
Поэтому, говоря о «кардиопротективности» применительно к антигипертензивным ЛС, мы предполагаем не только способность ЛС снижать ГМЛЖ, но и их способность влиять на жесткие конечные точки, такие как сердечно-сосудистая смертность и другие показатели сердечно-сосудистого риска.
Поскольку пусковым фактором развития ГМЛЖ является повышенное АД, следует предположить, что любой антигипертензивный препарат способен вызывать регресс ГМЛЖ.
В настоящее время вопрос о влиянии различных антигипертензивных ЛС на процессы гипертрофического ремоделирования миокарда ЛЖ остается в центре внимания. В 90-х годах был опубликован ряд обзоров клинических исследований, сравнивающих эффективность различных групп антигипертензивных препаратов на степень регресса ГМЛЖ. Авторы четырех наиболее крупных метаанализов, в которых проводилось сравнение разных групп препаратов по способности вызывать регресс гипертрофии ЛЖ, пришли к согласованному заключению — наиболее эффективно уменьшают ГМЛЖ препараты, снижающие активность РААС, — на 11,8–15% от исходного уровня.
В работе Klingbeil и соавт. (метаанализ 80 двойных слепых клинических исследований) также показано, что наибольшая степень снижения индекса массы миокарда ЛЖ на 13% была отмечена у больных, получавших терапию блокаторами рецепторов ангиотензина (БРА), на 11% — антагонистами кальция пролонгированного действия (АК), на 10% — ингибиторами ангиотензин-превращающего фермента (АПФ), на 8% — диуретиками, на 6% — бета-адреноблокаторами (БАБ) (рис. 2).
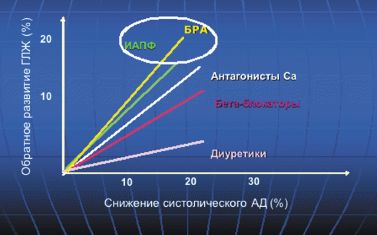
Таким образом, лидирующие позиции в этом списке также занимают блокаторы ренин-ангиотензиновой системы — ингибиторы АПФ и БРА, что свидетельствует о высокой роли активации ангиотензиновых рецепторов 1 типа в процессах развития гипертрофии миокарда ЛЖ.
Ингибиторы АПФ и блокаторы рецепторов ангиотензина
Кардиопротективные свойства ингибиторов АПФ и БРА заключаются не только в их способности вызывать регресс гипертрофии миокарда ЛЖ за счет блокады компонентов циркулирующей и тканевой РААС. Потенциальные кардиопротективные эффекты, такие как антиишемическое и антиаритмическое действие, связаны с возможностью этих препаратов восстанавливать нарушенную функцию эндотелия, стимулировать высвобождение оксида азота и простациклина за счет снижения деградации брадикинина, уменьшать потребность миокарда в кислороде за счет регрессии гипертрофии миокарда, снижать активность симпато-адреналовой системы, обусловленной стимуляцией ангиотензина II.
Нами были изучены долгосрочные эффекты различных ингибиторов АПФ и БРА на процессы ремоделирования у больных АГ. Было выявлено достоверное снижение показателей ГМЛЖ на фоне длительной (до трех лет) терапии ингибиторами АПФ эналаприлом, рамиприлом и каптоприлом и БРА ирбесартаном и телмисартаном (рис. 3). Динамика снижения показателей суточного мониторирования АД за период наблюдения была однонаправленной и достоверно значимой при лечении всеми препаратами. При анализе динамики снижения индекса массы миокарда ЛЖ было отмечено более выраженное достоверно значимое снижение данного показателя в группе больных, получавших терапию БРА, что согласуется с данными ряда других исследований.
Особого внимания заслуживают антиишемические свойства ингибиторов АПФ, которые были подтверждены рядом клинических исследований. Так, в исследовании HOPE (Heart Outcomes prevention evaluation study) с рамиприлом (ингибитор АПФ с высокой аффинностью к тканевой АПФ) было включено 9297 больных старше 55 лет с высоким риском ССО. Через 4,5 года наблюдения было отмечено достоверное снижение риска развития острого инфаркта миокарда, инсульта и коронарных событий, требующих проведения реваскуляризации, — то есть тех осложнений, которые являются привычными «спутниками» прогрессирующего атеросклеротического процесса. Результаты этого исследования еще раз подтвердили обоснованность и правомочность концепции, согласно которой предупреждение сердечно-сосудистой заболеваемости и смертности возможно путем блокады РААС на тканевом уровне.
Клиническое изучение антиишемических свойств ингибиторов АПФ у больных АГ в сочетании с ишемической болезнью сердца (ИБС), стабильной стенокардией напряжения было проведено на нашей кафедре. Под влиянием лечения периндоприлом и эналаприлом у больных АГ в сочетании с ИБС, стабильной стенокардией напряжения хорошая антигипертензивная эффективность сочеталась с антиангинальным эффектом и положительной динамикой показателей теста с физической нагрузкой. У больных, получавших терапию периндоприлом, отмечено также снижение суммарной продолжительности эпизодов ишемии миокарда (по результатам Холтеровского мониторования ЭКГ), уменьшение проявлений дисфункции эндотелия, улучшение диастолической функции миокарда у больных с нарушениями релаксации, а также улучшение локальной сократимости миокарда в виде уменьшения количества гипокинетичных сегментов как в покое, так и на высоте физической нагрузки (в условиях проведения стресс-ЭХО-КГ).
В последние годы стали широко доступны результаты крупных многоцентровых клинических исследований, посвященных изучению различных аспектов кардиопротекции относительно нового класса антигипертензивных ЛС — блокаторов рецепторов ангиотензина II. Так, в клиническом исследовании LIFE (Losartan Intervention For Endpoint reduction in hypertension) кардиопротективные свойства лозартана оценивались у 9193 больных АГ с ГМЛЖ по амплитудным критериям ЭКГ. Больные были разделены на группы лечения лозартаном или атенололом. В случае недостаточного контроля АД к терапии добавляли гидрохлортиазид. Длительность лечения составила в среднем 4,8 года. Между группами не было различий по исходным показателям АД и степени снижения АД на фоне активного лечения. В группе больных, получавших лозартан, было отмечено более выраженное снижение количественных признаков гипертрофии миокарда, чем в группе атенолола. Риск развития ССО был на 13% меньше в группе лозартана (23,8 событий на 1000 больных в год), чем в группе атенолола (27,9 событий на 1000 больных в год). Смертность ССО в группе лозартана была недостоверно ниже.
В рандомизированном двойном слепом исследовании CATCH (Candesartan Assessment in the Treatment of Cardiac Hypertrophy) было проведено сравнение эффективности кандесартана (8–16 мг/сут) и эналаприла (10–20 мг/сут) у больных АГ с ГМЛЖ (по данным ЭХО-КГ — индекс массы миокарда ЛЖ (ИММЛЖ) > 100 г/м2 у женщин и > 120 г/м2 у мужчин). Длительность наблюдения составила 1 год. В обеих группах отмечалось достоверное снижение ИММЛЖ (10,9 ± 15,5% и 8,4 ± 17,4%, p < 0,001). В группе больных, получавших кандесартан, положительная динамика отмечалась в 36% случаев, в группе эналаприла — в 30%.
Эффективность других БРА, в частности валсартана и ирбесартана, относительно возможностей регресса ГМЛЖ у больных АГ также была подтверждена в ряде долгосрочных клинических исследований.
Антагонисты кальция
По данным метаанализа клинических исследований антагонисты кальция пролонгированного действия по степени снижения ГМЛЖ уступают лишь блокаторам ренин-ангиотензиновой системы — они снижают ИММЛЖ в среднем на 11%. Наиболее изученным препаратом из группы АК пролонгированного действия является амлодипин. Его кардиопротективные свойства изучены в крупных клинических исследованиях, таких как ELVERA, ALLHAT, VALUE, ASCOT, PRESERVE.
В исследовании ELVERA (Effects of amlodipine and lisinopril on Left Ventricular mass) показано выраженное достоверное снижение индекса массы миокарда ЛЖ через 2 года лечения амлодипином у больных АГ с ГМЛЖ, которое сопровождалось улучшением диастолической функции ЛЖ.
Особого внимания заслуживает исследование ALLHAT (Antihypertensive and Lipid-lowering treatment to prevent heart attack trial) — рандомизированное двойное слепое исследование у больных АГ высокого сердечно-сосудистого риска эффективности лечения лизиноприлом, амлодипином, доксазозином и хлорталидоном по снижению фатальных исходов ИБС и нефатальных ИМ. В исследование было включено 33 357 больных, из них 9 тысяч получали лечение амлодипином. Длительность наблюдения составила 4,9 года. В группе больных, получавших лечение доксазозином, был отмечен значительно более высокий риск развития ССО, в связи с этим исследование эффективности данного препарата было приостановлено. Антигипертензивная эффективность в группах лечения хлорталидоном и амлодипином была сравнительно одинакова и превосходила эффективность в группе лечения лизиноприлом.
В исследовании VALUE (Valsartan Antihypertensive Long-term Use Evaluation) участвовали 15 245 больных АГ с высоким риском ССО в возрасте старше 50 лет. Длительность лечения составила в среднем 4,2 года. По результатам исследования риск развития у больных АГ сердечной заболеваемости и смертности был сопоставим в группах лечения амлодипином и валсартаном. На фоне терапии амлодипином было отмечено уменьшение риска развития инфарктов и инсультов.
В исследовании ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial) приняло участие 19 257 больных (средний возраст 63 года). Длительность наблюдения составила более 5 лет. Риск развития инфаркта миокарда и коронарных летальных заболеваний был меньше в группе больных, получавших амлодипин (4,5%), по сравнению с группой больных (4,9%), получавших атенолол.
В исследовании PRESERVE (Prospective Randomized Enalapril Study Evaluating Regression of Ventricular Enlargement) было выявлено, что при сравнимо одинаковой степени снижения АД у больных, получавших пролонгированную форму нифедипина в течение 1 года, степень снижении массы миокарда ЛЖ была выше, чем у больных, получавших эналаприл.
Бета-адреноблокаторы (БАБ)
По влиянию на выраженность ГМЛЖ и способности вызывать ее регресс БАБ уступают другим группам антигипертензивных препаратов. В среднем снижение ИММЛЖ составляет 5%. В то же время значимость и эффективность БАБ в отношении снижения риска ССО у больных кардиологического профиля очевидны и не вызывают сомнений. Во многом это объясняется основным механизмом действия БАБ, обусловленным снижением повышенного симпатического тонуса. Наиболее доступным маркером повышенной симпатической активности является высокая частота сердечных сокращений в покое. По данным эпидемиологических исследований было показано, что частый сердечный ритм у больных АГ является самостоятельным фактором риска развития ССО.
Достоверное снижение риска развития ССО и улучшение прогноза у больных кардиологического профиля на фоне приема различных БАБ были показаны в ряде клинических исследований, таких как МАPHY (Metoprolol Atherosclerosis Prevention in Hypertensives study), МRС (Medical Research Council study), CIBIS II (Cardiac Insufficiency Bisoprolol Study).
Диуретики
По данным метаанализа Klingbeil и соавт. тиазидовые диуретики, также как и БАБ, уступают другим группам препаратов по степени снижения у больных АГ с ГМЛЖ — в среднем снижение ИММЛЖ составляет 5%.
Иная ситуация складывается в отношении тиазидоподобного диуретика индапамида. В экспериментальных исследованиях было показано, что индапамид, диуретик со свойствами антагониста кальция, уменьшает массу миокарда ЛЖ за счет влияния на объем кардиомиоцитов и перицеллюлярный фиброз на уровне синтеза белков. Индапамид в низких дозах снижает и активность АПФ в плазме и миокарде, и индукцию мРНК кардиального АПФ, и уровень альдостерона в плазме.
Экспериментальные данные нашли подтверждение и в клинической практике. По данным исследования LIVE (Left ventricular hypertrophy: Indapamide Versus Enalapril) на фоне длительного лечения индапамидом 1,5 мг/сутки было отмечено достоверное уменьшение индекса массы миокарда ЛЖ по сравнению с терапией эналаприлом (20 мг/сут).
Нами также проводилось изучение индапамида у больных АГ с ГМЛЖ. В среднем регресс гипертрофии миокарда на 8,5% был отмечен на фоне монотерапии индапамидом в течение 1 года.
Комбинированная терапия
Современным приоритетным направлением в лечении больных АГ является использование комбинированной антигипертензивной терапии, позволяющей контролировать целевое АД у большинства больных.
Одной из наиболее рациональных и широко используемых является комбинация ингибиторов АПФ и диуретиков. Клинические данные, подтверждающие возможность снижения гипертрофии миокарда на фоне комбинированной терапии, отмечены в исследовании De Luca N и соавт.: по данным ЭХО-КГ через 12 месяцев на фоне комбинированной терапии ингибитором АПФ и диуретиком было отмечено более выраженное уменьшение ГМЛЖ по сравнению с группой лечения БАБ атенололом.
В исследовании, проведенном на нашей кафедре, режим комбинированной терапии (периндоприл 4–8 мг + индапамид 2,5 мг) у больных АГ с ГМЛЖ в течение года позволял достичь более выраженного эффекта в отношении регресса ГМЛЖ (снижение ИММЛЖ на 16,6%, р < 0,001) (рис. 4).
Данные кардиопротективного действия комбинации периндоприла с индапамидом были подтверждены результатами исследования PICXEL (Perindopril Indapamide combination in Controlled study Versus Enalapril). В исследование было включено 556 больных АГ с ГМЛЖ. ИММЛЖ достоверно снизился на 13,6 ± 23,9 г/м2 у больных, получавших комбинированную терапию. У больных, получавших монотерапию эналаприлом, снижение данного показателя составило 3,9 ± 23,9 г/м2 (p < 0,0001).
Снижение сердечно-сосудистого риска в результате длительного приема комбинированной терапии периндоприлом и индапамидом у больных АГ в сочетании с сахарным диабетом было продемонстрировано в ходе исследования АDVANCE (Action in Diabetes and Vascular Disease): вероятность возникновения ССО снижается на 14%, общая смертность — на 14%, сердечно-сосудистая смертность — на 18%.
По результатам исследования ACCOMPLISH (Avoiding Cardiovascular events through Combination therapy in Patients Living with Systolic Hypertension) было отмечено достоверное снижение относительного риска сердечно-сосудистой смертности и осложнений при приеме комбинации «ингибитор АПФ беназеприла и АК амлодипина» по сравнению с комбинацией «ингибитора АПФ беназеприла с диуретиком гидрохлортиазидом» на 20%.
Заключение
Таким образом, в настоящее время согласно Европейским и Российским рекомендациям при выборе тактики антигипертензивной терапии в каждой конкретной клинической ситуации необходимо учитывать особенности действия различных антигипертензивных препаратов, подтвержденные результатами клинических исследований. На основании большой доказательной базы относительно кардиопротективных свойств современных антигипертензивных лекарственных средств у больных АГ с ГМЛЖ препаратами выбора являются ингибиторы АПФ, антагонисты кальциевых каналов и БРА; у больных АГ с начальными признаками диастолической дисфункции — ингибиторы АПФ; у больных АГ в сочетании с ИБС — ингибиторы АПФ, БРА и БАБ.
Т. Е. Морозова, доктор медицинских наук, профессор Т. Б. Андрущишина ММА им. И. М. Сеченова, Москва
По вопросам литературы обращайтесь в редакцию.
Рис. 3. Влияние долгосрочной терапии ИАПФ на ГМЛЖ у больных АГ
Рис. 4. Сравнительная оценка эффективности комбинированной терапии: регресс ГМЛЖ
Купить номер с этой статьей в pdf
.jpg)
.jpg)
.jpg)









