Понятие метаболического синдрома (МС) объединяет ряд факторов сердечно-сосудистого риска, таких как абдоминальное ожирение, инсулинорезистентность, нарушения углеводного и липидного обмена, артериальная гипертензия, и постоянно дополняется новыми, например, маркерами сосудистого воспаления. Самостоятельное значение ряда факторов и их сочетаний не вполне определено, а диагностические критерии МС, предлагаемые разными источниками, имеют важные различия. Поэтому некоторые авторы предлагают изменить подход к МС и рассматривать его компоненты дифференцированно. В особенности это касается нарушений углеводного обмена. Инсулинорезистентность считается центральным компонентом МС и в ряде случаев может привести к нарушению толерантности к глюкозе (НТГ) и сахарному диабету (СД) 2-го типа. Гипергликемия является мощным независимым фактором сердечно-сосудистого риска, так как приводит к микрососудистым осложнениям.
Автономная нейропатия (АН) занимает среди них особое место по многим причинам: поздняя диагностика, ухудшение качества жизни и прогноза заболевания. Ее кардиоваскулярная форма неблагоприятным образом меняет суточную динамику артериального давления (АД), вызывает нарушения ритма, истощает адаптационный потенциал сердечно-сосудистой системы (ССС). Другие формы АН, например, гастроинтестинальная, менее изучены и еще более сложны для диагностики. Между тем их раннее выявление чрезвычайно важно, так как патогенетическая терапия наиболее эффективна именно на начальных стадиях, когда поражение нервных волокон обратимо.
Несмотря на неоднородность понятия МС, следует отметить, что его компоненты тесно связаны между собой. СД 2-го типа развивается не во всех случаях МС, но является его естественным следствием. Имеется ряд общих патогенетических механизмов — окислительный стресс, эндотелиальная дисфункция, накопление конечных продуктов гликозилирования, дисбаланс цитокинов, которые играют важную роль в развитии как МС, так и поздних осложнений СД. Что касается последних, описано их появление у больных с НТГ, когда, по принятым на сегодняшний день критериям, СД еще нет.
Поэтому целью исследования стало выявление вегетативной дисфункции у больных с МС и различными нарушениями углеводного обмена; выяснение ее связи с АН и изучение возможностей медикаментозной терапии.
Материалы и методы
Были обследованы 103 пациента с МС, диагностированным с помощью критериев программы ATP III, 36–72 лет. У 10 из них имелось НТГ, у 80 — СД 2-го типа средней продолжительностью 7,36 ± 0,41 года, у 13 больных не было обнаружено нарушений углеводного обмена.
Проводился опрос больных по аналогии со шкалой Neuropathy Symptoms Score. Диагноз АН ставился при выявлении ее кардиоваскулярной формы методом кардиоинтервалографии по Р. М. Баевскому. По наличию этого осложнения больные были разделены на две группы: группа 1 — 27 пациентов без электрофизиологических признаков АН и группа 2 — 76 больных с кардиоваскулярной АН. Для определения связи дисфункции желчевыводящих путей с гастроинтестинальной формой АН исключались сопутствующие заболевания желудочно-кишечного тракта (ЖКТ) и выполнялась ультразвуковая динамическая холецистография — измерение объема желчного пузыря натощак и спустя 45 минут после желчегонного завтрака.
Для статистического анализа материала использовался пакет прикладных программ Statistica 6.0. Достоверность различий оценивалась с помощью критерия Стьюдента.
Больным группы 2 назначалась патогенетическая терапия сроком на три месяца, после чего обследование повторялось. Они были разделены на три подгруппы, сходные по возрастно-половому составу и уровню компенсации углеводного обмена. 1-я подгруппа (27 человек) получала бенфотиамин (Мильгамма композитум) 300 мг/сут внутрь, 2-я (26 человек) — тиоктовую кислоту (Тиогамма) 600 мг/сут по стандартной схеме, 3-я (23 человека) — оба указанных препарата по тем же схемам.
Результаты и обсуждение
У всех пациентов, у которых в ходе кардиоинтервалографии была выявлена АН (группа 2), МС сопровождался выраженными нарушениями углеводного обмена в виде СД 2-го типа. Большую часть группы 1, без изменений вариабельности сердечного ритма (ВСР), составили больные без нарушений обмена углеводов или с НТГ. Из обследованных больных СД 2-го типа, развившегося на фоне МС, у подавляющего большинства имелись признаки АН — 95%.
В обеих группах встречались неспецифические проявления вегетативной дисфункции, главным образом, со стороны ССС и ЖКТ. Из кардиоваскулярных симптомов у пациентов группы 2 преобладала липотимия (71%), у 34% наблюдались дискомфорт или боли в области сердца. В группе 1 эти расстройства встречались значительно реже, соответственно у 33% и 15%. Частота сердцебиения или перебоев в области сердца была сходной в обеих группах (47% в группе 2, 41% в группе 1). Из желудочно-кишечных расстройств при подтвержденной кардиоваскулярной АН чаще всего встречались изжога (49%), отрыжка (50%), дискомфорт в эпигастрии после еды (46%) и запор (42%), несколько реже — боли в эпигастрии (30%), тошнота (25%) и диарея (14%). В отсутствии изменений ВСР частота отрыжки и изжоги была существенно ниже (26% и 30%), боли в эпигастрии не были отмечены. Запор в группе 1 встречался столь же часто, как и при наличии кардиоваскулярной АН (37%).
В табл. 1 отражены результаты исследования ВСР у больных МС. В группе 2 большинство показателей в покое и после ортостатического теста резко отличалось от таковых в группе 1, что иллюстрирует нарушение вегетативной регуляции, в первую очередь парасимпатической. По сравнению с фоновыми значениями, изменения показателей после функционального теста в группе 2 были существенно меньше, чем у больных с МС и сохранной вегетативной иннервацией ССС.
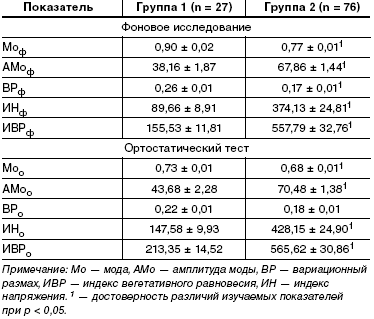
Преобладающим исходным вегетативным статусом у больных группы 1 была эйтония (63%), у остальных отмечалась симпатикотония или гиперсимпатикотония (по 18,5%). В группе 2, с более высокими значениями индекса напряжения, у 80% наблюдалась гиперсимпатикотония, у 17% — симпатикотония и лишь у 3% эйтония. Вегетативная реактивность, определяемая по соотношению индексов напряжения в фоновом исследовании и после ортостатического теста, была изменена в обеих группах. Гиперсимпатикотония была выявлена у 50% пациентов группы 2 и 41% группы 1, нормотония у 33% и 52%, а асимпатикотония — у 17% и 7%.
В обеих группах наблюдались различные нарушения сократительной функции желчного пузыря. У обследованных больных с МС объем желчного пузыря натощак был выше нормальных значений, приводимых в литературе. Однако при наличии кардиоваскулярной АН он был достоверно больше, чем при ее отсутствии (табл. 2).

Фракция выброса, напротив, имела тенденцию к снижению в группе 2. Однако этот показатель объединяет различные варианты нарушений моторной функции желчного пузыря, которые были выявлены у большей части больных МС (рис. 1).
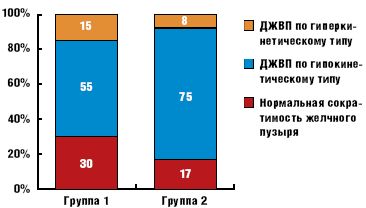
При наличии кардиоваскулярной формы АН (группа 2) у подавляющего большинства больных сократимость желчного пузыря была снижена, дискинезия желчевыводящих путей (ДЖВП) по гиперкинетическому типу наблюдалась в единичных случаях. В группе 1, при нормальной вегетативной иннервации ССС и относительно легких нарушениях обмена углеводов (меньшая вероятность длительной гипергликемии), также наблюдалась ДЖВП по гипокинетическому типу более чем в половине случаев. Особенностью этой категории больных была существенно более высокая частота ДЖВП по гиперкинетическому типу.
Снижение тонуса желчного пузыря и ДЖВП по гипокинетическому типу у больных с кардиоваскулярной АН обусловлено нарушением парасимпатической иннервации ЖКТ и гепатобилиарной системы, то есть гастроинтестинальной формой АН. Происхождение ДЖВП по гиперкинетическому типу менее определенно. Она может быть реакцией на гипергликемию при относительно сохранной иннервации ЖКТ, аналогичной усилению моторики желудка, результатом неадекватной секреции кишечных гормонов или проявлением скрытой гастроинтестинальной патологии. Сходные причины могут привести к дисфункции желчного пузыря при нормальной вегетативной иннервации ССС и слабо выраженных нарушениях углеводного обмена при МС. Нарушения секреции адипокинов, активация симпато-адреналовой системы при инсулинорезистентности также могут влиять на моторику ЖКТ.
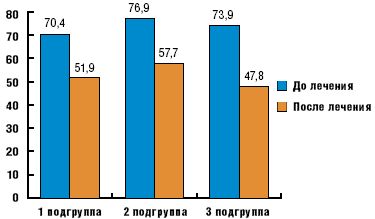
После курса патогенетической терапии улучшение самочувствия и субъективных проявлений АН отметили 59% больных, получавших бенфотиамин, 62% — тиоктовую кислоту и 78% — оба препарата. Лучше всего на лечение реагировали липотимия и легкие нарушения моторики ЖКТ: изжога, отрыжка, дискомфорт в эпигастрии.
На рис. 2 и рис.3 представлены изменения показателей кардиоинтервалографии в процессе лечения. Эффективность Мильгаммы композитум (1-я подгруппа) и Тиогаммы (2-я подгруппа) была сходной. Достоверно менялись интегральные показатели вегетативной регуляции (индексы напряжения и вегетативного равновесия) и мода (преобладающая продолжительность кардиоинтервала). Вариационный размах и амплитуда моды, отражающие состояние парасимпатической и симпатической регуляции, под влиянием лечения демонстрировали положительные тенденции, но преимущественного улучшения состояния какого-либо отдела вегетативной нервной системы выявлено не было. Комбинация Мильгаммы композитум и Тиогаммы, напротив, привела к достоверным изменениям всех рассматриваемых показателей в обоих тестах и более выраженному снижению индекса напряжения.
Под влиянием Мильгаммы композитум и Тиогаммы в одинаковой степени уменьшался объем желчного пузыря натощак и возрастало среднее значение фракции выброса (рис. 4), сходным образом снизилась частота ДЖВП по гипокинетическому типу (рис. 5).
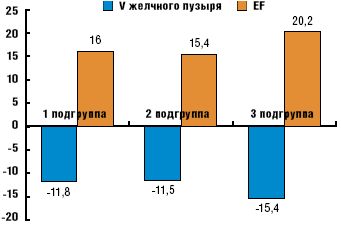
Одновременное применение двух препаратов (3-я подгруппа) позволило добиться более выраженных результатов по сравнению с монотерапией (рис. 4–5). Во всех подгруппах у немногочисленных пациентов с ДЖВП по гиперкинетическому типу в конце курса лечения не было выявлено нарушений моторной функции желчного пузыря.
Выводы
Признаки вегетативной дисфункции, встречающиеся у пациентов с метаболическим синдромом, являются проявлениями АН в большинстве случаев при наличии СД 2-го типа. При наличии кардиоваскулярной АН дисфункция желчного пузыря также обусловлена нарушением иннервации, что подтверждается и эффективностью Мильгаммы композитум и Тиогаммы при данном расстройстве. У больных МС без нарушения иннервации ССС, состояние углеводного обмена у которых более благоприятное, нельзя полностью исключить влияние гипергликемии и окислительного стресса на холинергические нервные волокна, но высокая частота ДЖВП связана, очевидно, и с другими причинами.
Мильгамма композитум и Тиогамма сравнимы по эффективности в улучшении показателей ВСР при кардиоваскулярной АН и моторной функции желчного пузыря при гастроинтестинальной ее форме. Применение комбинации этих препаратов позволяет добиться более значительного и комплексного эффекта при обеих рассмотренных формах нейропатии.
По вопросам литературы обращайтесь в редакцию.
С. В. Воробьев, доктор медицинских наук Д. А. Кириченко, А. И. Паленый, кандидат медицинских наук К. С. Караханян РостГМУ, Ростов-на-Дону
Купить номер с этой статьей в pdf









