Атопический дерматит (АД) у детей в последние годы приобретает все большее медико-социальное значение, так как его распространенность неуклонно растет, составляя в различных странах мира от 6% до 25%, а в России — до 35%. Существенно изменился патоморфоз АД у детей: отмечено более раннее появление первых признаков заболевания у детей c 1–2-месячного возраста (по нашим данным в 47% наблюдений); увеличилась частота тяжелых форм АД с расширением площади поражения кожи; возросла доля больных с хроническим рецидивирующим течением, торпидным к традиционной терапии.
АД — самое раннее и частое клиническое проявление атопии у детей, представляет собой хроническое, генетически обусловленное, аллергическое воспаление кожи (в основе которого лежат иммунные механизмы формирования), клинически характеризующееся зудом, возрастной морфологией высыпаний, локализацией и склонностью к рецидивирующему течению. Появляясь в раннем возрасте, АД быстро принимает хроническое рецидивирующее течение, вызывает страдания ребенка, значительно нарушает качество жизни больного и его семьи. Дискомфорт, связанный с кожным зудом, приводит к выраженным нарушениям сна, повседневной деятельности, социальных взаимоотношений. Кроме того, АД является первым проявлением «аллергического марша» и значимым фактором риска развития аллергического ринита и бронхиальной астмы у детей, поскольку эпикутанная сенсибилизация, формирующаяся при АД, сопровождается не только локальным воспалением кожи, но и системным иммунным ответом с вовлечением в процесс различных разделов респираторного тракта [1, 2, 3]. Поэтому своевременная диагностика АД и его патогенетическое лечение на ранних стадиях могут не только уменьшить степень тяжести обострения, но и модифицировать его развитие и предупредить аллергический марш атопических болезней.
Факторы риска. По современным представлениям АД — мультифакториальное заболевание, формирование которого тесно связано с генетическими дефектами иммунного ответа и отрицательными влияниями неблагоприятных факторов внешней среды. Причем сочетанное действие этих факторов определяет темпы развития АД, особенно у детей раннего возраста [4].
Ведущим фактором риска развития АД у детей является, прежде всего, наследственная предрасположенность к аллергии (82% наблюдений), которая проявляется изменениями системных механизмов наследования, связанными как с особенностями генетически запрограммированного иммунного ответа на антиген, так и с нарушениями генетического контроля продукции цитокинов, особенно интерлейкина-4 (ИЛ-4), что сопровождается повышением продукции IgЕ, специфической реакцией на определенный аллерген и генерализованной гиперчувствительностью [5].
В реализации наследственной предрасположенности особую роль играет высокий уровень антигенной нагрузки на плод (57%), связанной с патологическим течением беременности и родов, с нарушениями питания матери во время беременности и лактации; курением, поздним прикладыванием к груди, c ранним искусственным вскармливанием, а также с ранним введением прикорма и продуктов, не соответствующих возрасту ребенка [5, 6]. Несомненна роль таких факторов, как частые вирусные и паразитарные инфекции и наличие очагов хронической инфекции у детей (56%) [6]. Доказана значимость нарушений функционального состояния центральной и вегетативной нервной систем, которые контролируют активацию иммунокомпетентных клеток и механизмы зуда посредством специфических нейропептидов. Установлено значение аутоаллергенов, освобождающихся из воспалительно-измененных тканей, особенно при расчесывании, которые поддерживают иммунный ответ, первично вызванный аллергенами окружающей среды.
Существенным фактором риска АД являются также нарушения экологии, среды обитания и микроокружения ребенка, которые могут усиливаться «современными стандартами жизни» [1, 7]. Большое значение имеет также органическая и функциональная патологии различных органов и систем желудочно-кишечного тракта (ЖКТ) — ферментопатии, хеликобактерная инфекция, нарушения микробиоценоза кишечника. Возникающие при этом нарушения вызывают повреждения пищеварительного барьера слизистой оболочки ЖКТ, что сопровождается снижением активности факторов неспецифической защиты, уменьшением продукции секреторного IgA, способствует повышенному накоплению гистамина, кининов, провоспалительных цитокинов, приводит к увеличению проницаемости слизистой оболочки для аллергенов и их усиленному всасыванию, что является одним из значимых пусковых механизмов сенсибилизации и реализации аллергического воспаления в коже [5, 7].
В последние годы особенное внимание уделяется дисбиозу кишечника как фактору формирования АД, так как нормальная микрофлора кишечника играет важнейшую роль в становлении иммунной системы ребенка и обладает протективным действием в формировании атопии. Показано, что ранние нарушения микрофлоры кишечника у младенцев вызывают дефицит специфических микробных штаммов, обеспечивавших в норме защиту от избыточной антигенной сенсибилизации, путем повышенной продукции таких цитокинов, как ИЛ-10 и трансформирующий фактор роста бета (TФР-бета) [8]. Эта концепция была подтверждена после того, как было установлено, что перинатальное и постнатальное системное назначение пробиотической флоры, особенно Lactobacillus rhamnosus, привело к 50% снижению развития АД у детей группы риска [8].
У 86% детей с АД нами были выявлены различные формы патологии ЖКТ. При этом абдоминальный синдром разной степени выраженности был установлен у 78% больных АД. Патология гастродуоденальной зоны выявлялась в 68% наблюдений: симптомы желудочной диспепсии (отрыжка, изжога, тошнота, рвота) отмечались у 45%, а симптомы кишечной диспепсии (метеоризм, запоры, жидкий стул) — у 39% больных АД. Патология гепатобилиарной системы у больных АД была выявлена в 42%, патология поджелудочной железы — в 51%, а дисбиоз кишечника — в 82% наблюдений у больных АД [9].
Ведущими причинно-значимыми аллергенами при АД являются пищевые аллергены, особенно у детей первого года жизни (99% случаев). По существу, пищевая аллергия является стартовой сенсибилизацией, на фоне которой путем перекрестных реакций формируется гиперчувствительность к другим аллергенам. Частыми пищевыми аллергенами по нашим данным являются белки коровьего молока (84%), куриное яйцо (91%), рыба (52%), глютен (40%), говядина (36%), бананы (32%), злаковые (27%), соя (26%) [5]. Однако доминирующая роль пищевой аллергии постепенно уменьшается с ростом ребенка, но увеличивается значимость аэроаллергенов, прежде всего бытовых (38%), эпидермальных (35%), пыльцевых (32%), бактериальных (20%) и грибковых (15%) аллергенов [1, 9].
Среди бактериальных аллергенов при АД установлена значимая роль золотистого стафилококка, который в 80–90% случаев является основным микроорганизмом, колонизирующим пораженные участки кожи и выделяющим экзотоксины со свойствами суперантигенов, которые ингибируют апоптоз и стимулируют пролиферацию Т-лимфоцитов, что ускоряет хронизацию аллергического воспаления кожи [10]. Эндогенная бактериальная сенсибилизация (20%), связанная с наличием у детей очагов хронической инфекции, способствует гиперпродукции IgE и является причиной тяжелого течения АД [9]. В развитии и поддержании патологического процесса в коже активное участие принимают различного рода грибы, особенно дрожжеподобные, которые являются частью нормальной микрофлоры кожи, но становятся выраженными патогенами при АД у детей. Уровень поражения кожи дрожжеподобными грибами при АД значительно выше при диффузном поражении кожи, при этом отмечают особую роль липофильных дрожжеподобных грибов Malassezia furfur и Candida albicans (у 49% больных АД) [9, 10].
Патогенез. В основе патогенеза АД лежат иммунные механизмы с ведущей ролью Т-лимфоцитов и клеток Лангерганса. Причем клетки Лангерганса являются основными клетками, ответственными за IgE-опосредованное накопление аллергенов в коже и их презентацию Т-лимфоцитам. Их количество у больных АД значительно выше, чем у здоровых. В этом видят одну из главных причин преимущественного поражения кожи при АД. Клетки Лангерганса играют важную роль в поддержании низкого уровня митотической активности кератиноцитов и инициируют апоптоз, ограничивающий их пролиферацию. Получив информацию, клетки Лангерганса перемещаются в лимфатические узлы, где вступают во взаимодействие с Th0-лимфоцитами, что способствует активации Т-хелперов и усилению дифференцировки их в сторону Th2-лимфоцитов [9, 11]. Этот процесс сопровождается выделением цитокинов. Th2-лимфоциты продуцируют ИЛ-4, ИЛ-5, ИЛ-10, ИЛ-13 и способствуют активации В-лимфоцитов с локальной гиперпродукцией специфических IgE. Преобладание в среде цитокинов ИЛ-4 и ИЛ-13 способствует увеличению числа Th2-клеток и переключению В-клеток на продукцию IgE. При этом уменьшается продукция гамма-интерферона и активность Th1-лимфоцитов. В то же время антиген может соединяться и с рецепторами IgE тучных клеток, которые продуцируют ИЛ-4, ИЛ-5, эозинофильный хемотаксический фактор, а также гистамин и триптазу. При повторном поступлении аллергена происходит дегрануляция тучных клеток с выделением медиаторов воспаления и хемотаксических агентов, которые запускают раннюю фазу аллергической реакции, клинически проявляющуюся выраженным зудом, гиперемией, отеком. Под действием ИЛ-5, ИЛ-6, ИЛ-8 происходит усиление миграции эозинофилов и макрофагов в воспалительный очаг, что определяет темпы хронизации аллергического воспаления кожи. В этом процессе особое значение имеют эозинофилы-долгожители, которые менее подвержены апоптозу, продуцируют высокие уровни основного белка эозинофилов, что способствует активации Th1-лимфоцитов с преимущественной продукцией интерферона-гамма [9, 11]. Наряду с иммунными механизмами в патогенезе АД имеют значение повреждения рогового слоя эпидермиса и водно-липидной пленки в результате аллергического воспаления. Патофизиология АД заключается в том, что в результате аллергического воспаления кожи у детей снижаются ее барьерные функции и увеличивается склонность к вторичному инфицированию, так как существенное увеличение трансэпидермальных потерь воды приводит к патологической сухости и усилению зуда кожи, нарушениям физиологической десквамации эпидермиса с утолщением рогового слоя и выраженным шелушением.
Вместе с тем нужно отметить, что многие механизмы повреждений кожи при АД еще недостаточно изучены. В частности, не ясно, почему у детей грудного возраста проявления АД бывают только на лице или могут иметь распространенный характер, а у детей старшего возраста отмечается преимущественно складчатый характер поражений кожи.
Клиника АД у детей проявляется зудом кожи, возрастной морфологией высыпаний (папулы, везикулы, экссудация, лихеноидные папулы, экскориации), типичной локализацией, возрастной стадийностью и хроническим течением. Обычно манифестация АД происходит на первом году жизни. В своем развитии болезнь проходит три стадии, которые могут быть разделены периодами ремиссии или могут переходить одна в другую [1, 10].
Младенческая стадия АД развивается у детей в возрасте до двух лет и в 70% случаев характеризуется наличием выраженной экссудации и мокнутия с развитием острого воспаления кожи в виде эритемы, отека, высыпаний в виде папул и микровезикул (так называемая экссудативная форма). Эти проявления локализованы чаще всего на лице или имеют распространенный характер с поражением кожи туловища и конечностей. Для 30% больных характерны гиперемия, инфильтрация и легкое шелушение кожи без экссудации — это проявления эритемато-сквамозной формы АД.
Детская стадия АД выявляется у детей от 2 до 13 лет и проявляется складчатым характером поражения кожи, ее утолщением, гиперкератозом, наличием эритематозных папул. Затем формируются лихеноидные папулы и очаги лихенификации с типичной локализацией в складках кожи, характеризующие лихеноидную форму АД. У 52% детей в этой стадии АД характерно поражение лица (атопическое лицо), проявляющееся гиперпигментацией, шелушением кожи век, вычесыванием бровей, явлениями хейлита.
Подростковая стадия АД у детей старше 13 лет характеризуется резко выраженной лихенизацией, сухостью и шелушением, преимущественными поражениями кожи лица, верхней части туловища и непрерывно рецидивирующим течением [10].
По распространенности различают: ограниченный АД — с локализацией преимущественно на лице и площадью поражения кожи не более 5%; распространенный АД — с площадью поражения 5–50%; диффузный АД — с обширным поражением кожи более 50% [10].
По степени тяжести АД выделяются следующие варианты течения:
-
легкое: ограниченное поражение кожи (площадь поражения не более 5%), слабый зуд, не нарушающий сон больного, и невыраженные симптомы поражения кожи (небольшая гиперемия или экссудация, единичные папулы и везикулы), редкие обострения 1–2 раза в год;
-
среднетяжелое: распространенное поражение кожных покровов (площадь поражения от 5 до 50%), умеренный или сильный зуд кожи, нарушающий сон ребенка, воспалительная реакция кожи (значительная гиперемия, экссудация или лихенизация, множественные расчесы) и наличие обострений 3–4 раза в год;
-
тяжелое: диффузное поражение кожи (площадь поражения более 50%), сильный, мучительный, с частыми пароксизмами, резко нарушающий сон и качество жизни ребенка, выраженная гиперемия, экссудация или лихенизация, множественные расчесы, трещины, эрозии, непрерывно рецидивирующее течение.
Выделяют также три фазы течения АД: острое, подострое и хроническое течение.
Лечение АД у детей является одной из сложных задач для врача-педиатра, терапия должна быть патогенетической, комплексной и направленной на ограничение и уменьшение воспалительного процесса в коже [1, 9].
Основными направлениями лечения АД являются:
-
элиминация причинно-значимых аллергенов: в современных условиях преимущественно с помощью энтеросорбции и назначения гипоаллергенной диетотерапии;
-
системная фармакотерапия с использованием антигистаминных препаратов и блокаторов медиаторов аллергической реакции;
-
дифференцированная коррекция сопутствующей патологии (лечение патологии органов пищеварения, метаболитная и антиоксидантная терапия, нормализация функциональных нарушений нервной системы, санация очагов хронической инфекции);
-
иммунотерапия;
-
наружная терапия.
В острый период АД у детей, особенно при его осложненном течении, при быстрой манифестации процесса и раннем поступлении больного ребенка в клинику, рекомендуются мероприятия по выведению аллергенов и продуктов аллергической реакции из организма. Среди них важнейшим является проведение энтеросорбции.
Энтеросорбция является неинвазивным методом связывания и выведения из организма аллергенов, медиаторов, продуктов аллергической реакции, метаболитов, токсинов, активных перекисных соединений, условно-патогенной флоры и вирусов. Энтеросорбция осуществляется введением в полость кишечной трубки различных твердых или жидких соединений естественного или искусственного происхождения, обеспечивающих поглощение, связывание и удаление экзогенных и эндогенных токсинов, и направлена на детоксикацию организма и восстановление его реактивности. При этом используются как прямые (непосредственные), так и опосредованные эффекты энтеросорбции.
Прямые эффекты энтеросорбции обеспечиваются различными физико-химическими механизмами (адсорбции, абсорбции и хемосорбции, ионообмена и комплексирования), протекающими на активной поверхности различных пористых систем при движении энтеросорбента в просвете кишки. При этом молекулы небольшого размера сорбируются преимущественно в микропорах с радиусом менее 1,5 нм, молекулы средней и высокой массы поглощаются мезопорами с радиусом от 1,5 до 200 нм, а субклеточные надмолекулярные структуры и клетки сорбируются в макропорах с радиусом более 200 нм.
Опосредованные эффекты энтеросорбентов обеспечивают ослабление и предотвращение аллергического воспаления, профилактику эндо- и экзотоксикозов, уменьшение метаболической нагрузки на выделительную систему, коррекцию обменных процессов и иммунного статуса больного ребенка, восстановление целостности и проницаемости слизистых оболочек, улучшение функционального состояния кишечника.
Энтеросорбенты классифицируются по следующим параметрам [1, 10]:
-
по лекарственной форме препарата — гранулы (угли), порошки (Карболен, Холестирамин), таблетки, пасты (пектины, хитин);
-
по химической структуре — угли активированные, алюмосиликаты (Смекта), гидрогель полиметилсилоксана (Энтеросгель), из морских водорослей (Альгисорб), пиролизованная целлюлоза (Полифепан);
-
по структурно-сорбционным характеристикам — высокодисперсные порошки с высокоразвитой площадью поверхности (до 1000 м2/г) — полисорб; пористые сорбенты, содержащие поверхностные поры — уголь; со структурой глобулярной матрицы — Энтеросгель;
-
по природе поверхности — гидрофильные, гидрофобные, смешанные;
-
по механизмам сорбции — адсорбенты, абсорбенты, ионообменные материалы, сорбенты с катаболическими свойствами, сорбенты с сочетанным механизмом;
-
по избирательности сорбции — селективные (Энтеросгель), полифункциональные, неселективные (угли активированные, природные препараты — лигнин, хитин, целлюлоза).
Неселективные энтеросорбенты являются универсальными, поскольку они обладают способностью связывать различные по свойствам вещества. Основной их недостаток заключается в том, что эти сорбенты могут влиять и на жизненно необходимые для организма процессы — обмен микроэлементов и витаминов.
Особенностью селективных энтеросорбентов является их способность эффективно осуществлять детоксикацию организма, т. е. извлекать из химуса и содержимого желудочно-кишечного тракта токсичные или потенциально опасные соединения и метаболиты — бактериальные токсины, аллергены, биологически активные вещества и не сорбировать микроэлементы и электролиты.
Процессы сорбции осуществляются четырьмя основными путями. Первый из них — это адсорбция, представляющая собой взаимодействие между сорбентом и сорбатом на границе раздела сред. Адсорбенты имеют пористую основу, которая способствует накоплению и фиксации в порах веществ за счет их физико-химических свойств. Это приводит к снижению концентрации сорбируемых веществ в окружающей среде, т. е. в просвете желудочно-кишечного тракта. Второй путь — это абсорбция, которая состоит в поглощении сорбата всем объемом сорбента, т. е. имеет место растворение вещества. Третий путь — ионообмен, когда происходит замещение ионов на поверхности сорбента ионами сорбата (ионообменные смолы). Четвертый путь сорбции — комплексообразование, являющееся сложным комбинированным процессом нейтрализации, транспорта и выведения из организма антигенов, продуктов метаболизма (билирубин) и др.
Сравнительная характеристика современных энтеросорбентов, использующихся в клинической практике, представлена в таблице. Представленные данные свидетельствуют, что Энтеросгель является единственным высокоселективным энтеросорбентом, имеет широкий диапазон и наиболее высокий коэффициент избирательности сорбции.
При выборе препарата врачу необходимо учитывать следующие требования к имеющимся энтеросорбентам: высокая эффективность сорбции при полной безвредности и нетоксичности; хорошая биосовместимость с тканями; высокая сорбционная емкость по отношению к удаляемым компонентам; селективная сорбция среднемолекулярных токсических метаболитов; отсутствие повреждающего действия на слизистые оболочки желудка и кишечника; отсутствие воздействия или позитивное влияние на процессы секреции и микробиоценоз кишечника; удобная фармацевтическая форма.
Как показано в таблице, этим требованиям в полной мере соответствует единственный селективный энтеросорбент — Энтеросгель, обладающий следующими свойствами:
-
безопасен при применении, полностью безвреден;
-
имеет большую сорбционную емкость, в 2,5 раза превосходит другие типы сорбентов;
-
обладает цитопротективными свойствами;
-
имеет высокую биосовместимость с тканями кишечника;
-
нетравматичен, не повреждает слизистые оболочки органов ЖКТ;
-
гидрофобен, не проникает через слизистые оболочки органов ЖКТ;
-
образует гидрогель, обволакивающий слизистую оболочку;
-
осуществляет адгезию патогенной микрофлоры;
-
избирательно действует на микробиоценоз кишечника.
Основными показаниями к назначению энтеросорбентов у детей, страдающих АД, являются обострение течения основного заболевания, наличие сопутствующей патологии органов ЖКТ, тяжелое течение АД с выраженной интоксикацией, осложненные инфекцией формы АД, а также формирование АД у детей, проживающих в экологически неблагополучных регионах.
В ходе клинических исследований нами было установлено, что наиболее эффективным при лечении АД у детей является использование Энтеросгеля как активного селективного сорбента с выраженным цитопротективным действием. Механизм терапевтического воздействия этого препарата при АД непосредственно определяется сорбцией пищевых аллергенов, гистамина, серотонина, эндотоксинов различной природы, циркулирующих иммунных комплексов, бактериальных антигенов, адгезией патогенной флоры и нормализацией микробиоценоза кишечника у детей.
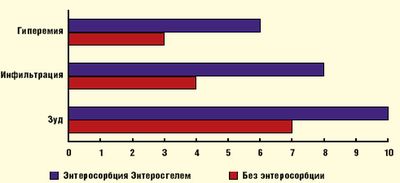
По нашим данным высокоэффективно использование Энтеросгеля у детей, страдающих АД, при сочетанном поражении кожи и гастроинтестинального тракта, а также при осложненном различными инфекциями течении АД. При этом купирование симптомов со стороны кожи происходит значительно быстрее, чем при обычных методах терапии: гиперемия и инфильтрация кожи значимо уменьшаются на 3–4 сутки курсового лечения Энтеросгелем, зуд кожи существенно ослабляется к 7 дню терапии (рис. 1).
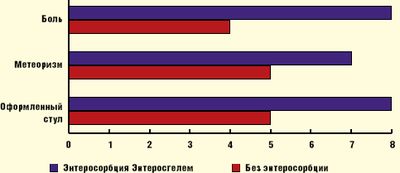
Собственный опыт применения Энтеросгеля в комплексном лечении АД у детей выявил также его существенное позитивное влияние на функциональное состояние желудочно-кишечного тракта: болевой синдром, метеоризм и стул нормализовались на 4–5 сутки курсового лечения, что указывает на высокую эффективность этого энтеросорбента (рис. 2).
Способ применения и рекомендуемые дозы Энтеросгеля представлены на рис. 3. Принимать Энтеросгель следует внутрь 2 раза в сутки за 1,5–2 часа до еды (утром натощак) и/или через 2 часа после ужина и приема лекарств. Способ приготовления Энтеросгеля для маленьких детей — разведение в теплой кипяченой воде в соотношении 1:10. Продолжительность приема Энтеросгеля при АД у детей — до 2–4 недель.

Таким образом, энтеросорбция является эффективным и безопасным методом комплексной терапии АД у детей. Она позволяет в более короткие сроки купировать обострение аллергического процесса, существенно улучшить течение основного заболевания, сопутствующей патологии и предупредить формирование осложнений. Применение Энтеросгеля у детей, страдающих АД, показало его выраженную клиническую эффективность, обусловленную высокой селективностью, нетоксичностью, значимым цитопротективным действием и, что особенно важно в педиатрической практике, удобной фармацевтической формой препарата, позволяющей использовать его в течение длительного времени при отсутствии отрицательных органолептических свойств.
Очевидно, что энтеросорбция, как и другие способы лечения аллергической патологии у детей, будет совершенствоваться по различным направлениям. На современном этапе эволюции технологических возможностей создания энтеросорбентов Энтеросгель, несомненно, занимает ведущее место среди конкурирующих неинвазивных средств детоксикации и метаболической коррекции функционального состояния детей и подростков.
Литература
-
Смирнова Г. И. Аллергодерматозы у детей. М.: БУК лтд., 1998. 300 с.
-
Jaffe R. Atopic dermatitis // Prim. Care. 2000. Vol. 27. P. 503–513.
-
Gehring U., Bischof W., Fahlbusch B., Wichmann H., Heinrich J. House dust endotoxin and allergic sensitization in children // Am. J. Respirat. Crit. care Med. 2002. Vol. 166, № 7. P. 939–944.
-
Edwards A. Mechanisms of allergic disease / In: The Year in Allergy 2003/Eds. S. Holgate and S. Arshad. Oxford, 2003. P. 83–100.
-
Holgate S. T., Puddicombe S. M., Mullings R. E. et al. New insights into asthma pathogenesis // Allergy Clin. Immunol. Int. 2004. Vol. 16, № 5. P. 196–201.
-
Kay A. B. Modulation of inflammation in allergic disease // Allergy Clin. Immunol. Int. 2004. Vol. 16, № 5. P. 206–210.
-
Kondo H., Ichikawa Y., Imokawa G. Percutaneous sensitization with allergens through barrier-disrupted skin elicits a Th2-dominant cytokine response // Eur. J. Immunol. 1998. Vol. 28. P. 769–779.
-
Rautava S., Kalliomaki M., Isolauri E. Probiotics during pregnancy and breastfeeding might confer immunomodulatory protection against atopic disease in the infant // J. Allergy Clin. Immunol. 2002. Vol. 109, № 1. P. 119–121.
-
Смирнова Г. И. Диагностика и cовременные методы лечения аллергодерматозов у детей// Рос. педиатр. журн. 2002. № 3. С. 40–44.
-
Смирнова Г. И. Современная концепция атопического дерматита у детей. М., 2006.132 с.
-
Lambrecht B. N. Dendritic cells and the regulation of the allergic immune response // Allergy. 2005. Vol. 60, № 3. P. 271–282.
Г. И. Смирнова, доктор медицинских наук, профессор ММА имени И. М. Сеченова, Москва
Купить номер с этой статьей в pdf
.jpg)
.jpg)
.jpg)









