Врачи, профессиональные обязанности которых связаны с необходимостью лечения большого числа больных, испытывающих хроническую боль неонкологической природы (прежде всего, ревматологи и неврологи), нуждаются в наличии среди своего терапевтического арсенала эффективных, удобных и недорогих анальгетических препаратов. Такую позицию на современном фармакологическом рынке занимают неселективные нестероидные противовоспалительные препараты (н-НПВП) [1, 2]. Это большое семейство т. н. «традиционных» средств, основное фармакологическое действие которых связано с блокадой циклооксигеназы-2 (ЦОГ-2) и снижением синтеза провоспалительных простагландинов, терапевтическое применение которых насчитывает более 130 лет — с того момента, когда были опубликованы первые данные об эффективности салициловой кислоты при остром ревматизме [3]. На сегодняшний день в России зарегистрировано и широко используется 11 представителей группы н-НПВП: ацетилсалициловая кислота, ибупрофен, индометацин, пироксикам, лорноксикам, кетопрофен, декскетопрофен, напроксен, кеторолак, диклофенак и ацеклофенак.
Диклофенак долгое время считался «золотым стандартом» среди НПВП. Обладая умеренной селективностью в отношении ЦОГ-2 (соотношение ингибирующей активности в отношении этого фермента и его физиологической изоформы ЦОГ-1 составляет примерно 1:1), этот препарат сочетает высокую обезболивающую и противовоспалительную активность и обладает вполне удовлетворительной, по сравнению с большинством других н-НПВП, переносимостью [2, 4, 5]. Так, в 1994 г. Henry D. и сотр. провели анализ всех доступных им данных по частоте развития желудочно-кишечных кровотечений и перфорации язв при использовании различных НПВП, что позволило авторам представить градацию основных представителей этой лекарственной группы в зависимости от риска развития опасных ЖКТ-осложнений. Диклофенак занимал в этом списке почетное второе место, лишь в 2 раза превышая по токсичности наиболее безопасный по тем временам препарат из группы н-НПВП — ибупрофен и далеко оставив позади такие популярные лекарства, как индометацин, пироксикам и кетопрофен [6]. Последующие исследования подтвердили это соотношение. Так, в популяционном исследовании Lanas A. и сотр. (2006) среди н-НПВП риск развития ЖКТ-осложнений на фоне приема диклофенака и ибупрофена также оказался в несколько раз меньше, чем при использовании трех указанных выше препаратов [7].
При этом необходимо отметить, что ибупрофен является относительно безопасным средством лишь при использовании его в низких, анальгетических дозах (до 1600 мг/сутки). Повышение дозы этого препарата закономерно сопровождается нарастанием риска развития лекарственных осложнений, и в стандартных противовоспалительных дозах (до 2400 мг/сутки) он не менее опасен, чем индометацин [6].
Переносимость диклофенака успешно выдерживала сравнение с селективными НПВП в ходе ряда рандомизированных контролируемых исследований (РКИ), в частности, масштабного 18-месячного MIDAL (диклофенак vs этерококсиб, n = 34,701) [8]. Это позволило одному из ведущих мировых экспертов по вопросу эффективности и безопасности этого класса лекарственных средств Singh G. отнести этот препарат к числу «низкотоксичных» НПВП. Мнение Singh G. подтверждается данными популяционного исследования «Comparing Apples with Oranges…» («Сравнение яблок и апельсинов…»), в котором оценивался риск развития опасных ЖКТ-осложнений у 688424 жителей Калифорнии, США, в 1999–2005 гг. регулярно принимавших различные НПВП. Оказалось, что диклофенак вызывал серьезные нежелательные эффекты на 30% чаще, чем знаменитые своей безопасностью «коксибы» — целекоксиб (относительный риск, ОР 0,72) и валдекоксиб (ОР 0,73), и достоверно не отличался от рофекоксиба, но при этом существенно превосходил по своей безопасности такой популярный в США НПВП, как напроксен [9].
Однако следует быть откровенным — слава «золотого стандарта» среди НПВП была завоевана не абстрактным диклофенаком, а оригинальным препаратом, созданным швейцарской компанией Ciba-Gaigi. Этот препарат, в настоящее время выпускаемый фирмой «Новартис», до сих пор широко используется во всем мире, и именно он применялся в ходе большинства известных клинических исследований НПВП, предусматривающих назначение диклофенака в качестве препарата сравнения [2, 4, 5].
К сожалению, репутация диклофенака в нашей стране была испорчена после появления на фармакологическом рынке огромного количества генериков этого препарата. Эффективность и безопасность подавляющего большинства этих «диклофенаков» не была проверена в ходе хорошо организованных и длительных РКИ [5]. Правда, генерики дешевы и вполне доступны социально незащищенным слоям населения нашей страны, что сделало диклофенак самым популярным НПВП в России. По данным опроса 3000 больных в 6 регионах России и Москве, регулярно получающих НПВП, этот препарат использовали 72% респондентов [10]. Однако низкая стоимость, пожалуй, является единственным достоинством дешевых генериков.
Именно с генерическим диклофенаком в последнее время связано наибольшее абсолютное число опасных лекарственных осложнений, наблюдаемых в нашей стране. По нашим данным, среди 3088 ревматологических больных, регулярно принимавших диклофенак, язвы и эрозии ЖКТ были выявлены у 540 (17,5%). Интересно, что частота ЖКТ-осложнений на фоне приема диклофенака не отличалась от частоты подобных осложнений, возникших при использовании общепризнанно более токсичных препаратов — индометацина (17,7%) и пироксикама (19,1%) [11].
Очень важно мнение самих пациентов о безопасности лекарственного препарата, и мнение это основывается, прежде всего, на его субъективной переносимости. Ведь в реальной клинической практике риск развития НПВП-гастропатии — бессимптомных язв и относительно редких, угрожающих жизни осложнений — кровотечений и перфорации (эта патология возникает, к счастью, менее чем у 1 из 100 больных в течение года регулярного приема НПВП) беспокоит пациентов меньше, чем появление выраженной диспепсии. Боли в эпигастральной области, тяжесть и тошнота возникают как минимум у каждого пятого больного, получающего НПВП (по нашим данным, более 30%), причем сами больные определяют четкую взаимосвязь между развитием этих симптомов и приемом лекарств [10, 12–14].
Важно отметить, что развитие диспепсии, в отличие от НПВП-гастропатии, в большей степени определяется контактным действием НПВП, следовательно, зависит от фармакологических свойств конкретного препарата. Зачастую препараты различных коммерческих фирм, содержащие одно и то же действующее вещество, обладают различной переносимостью, и это, прежде всего, относится к дешевым генерикам диклофенака [12].
Из-за широкого применения генериков, существенно потеснивших на фармакологическом рынке более качественный, но существенно более дорогой оригинальный препарат, у многих российских врачей и пациентов создалось мнение о диклофенаке как о препарате с умеренной эффективностью, но с высоким риском нежелательных эффектов. К сожалению, хотя ведущие российские эксперты неоднократно заявляли о существенных различиях в эффективности и безопасности между оригинальным диклофенаком и его дешевыми копиями, до настоящего времени не было проведено каких-либо серьезных клинических исследований в нашей стране для того, чтобы подтвердить это положение.
Другим аспектом проблемы безопасности диклофенака является повышение риска кардиоваскулярных катастроф. Этот вопрос активно обсуждается в последние годы в свете печально знаменитого «кризиса коксибов» и повышенного внимания к возможности класс-специфического негативного влияния НПВП на состояние сердечно-сосудистой системы. Так, согласно данным, полученным McGettigan P. и Henry D. (2006) в ходе метаанализа наиболее крупных наблюдательных и когортных исследований НПВП, применение диклофенака ассоциируется с наибольшим риском развития инфаркта миокарда, по сравнению с другими популярными н-НПВП. Для диклофенака ОР этого тяжелого осложнения составил 1,4, в то время как для напроксена 0,97, для пироксикама 1,06, для ибупрофена 1,07 и для индометацина 1,3 [15].
Определенную тревогу при использовании диклофенака вызывает возможность развития такого редкого, но потенциально угрожающего жизни осложнения, как острый лекарственный гепатит и острая печеночная недостаточность [16]. Еще в 1995 г. медицинским контролирующим органом США (FDA) были представлены данные анализа 180 случаев серьезных осложнений со стороны печени при использовании этого препарата, в т. ч. приведшие к летальному исходу. При этом в США диклофенак не являлся столь широко используемым НПВП (уступая ацетилсалициловой кислоте, ибупрофену и напроксену). К моменту проведения анализа диклофенак применялся в США лишь 7 лет, поскольку был допущен FDA на фармакологический рынок этой страны только в 1988 г. [17].
Суммируя вышесказанное, мы можем заключить, что на сегодняшний день диклофенак не может считаться истинным «золотым стандартом» среди н-НПВП, прежде всего потому, что достаточно высокая частота нежелательных эффектов, возникающих на фоне приема этого препарата, уже не соответствует современным представлениям о безопасной анальгетической терапии.
Альтернативой диклофенака на российском фармакологическом рынке может стать его «ближайший родственник» ацеклофенак. Этот интересный препарат обладает существенными достоинствами — прежде всего, высокой эффективностью, безопасностью и доступностью, позволяющей ему претендовать на место н-НПВП с наилучшим на сегодняшний день сочетанием фармакологических свойств. Ведущие зарубежные и российские эксперты и, прежде всего, академик В. А. Насонова высказали свое положительное мнение по данному вопросу [18–21].
Ацеклофенак — производное фенилацетиловой кислоты, являющейся представителей промежуточной группы (выделяемой отдельными авторами) «преимущественно селективных ЦОГ-2 ингибиторов». Так, по данным Saraf S., соотношение ингибирующих концентраций ЦОГ-2/ЦОГ-1 у этого препарата составляет 0,26, и это меньше, чем у эталонного селективного ингибитора ЦОГ-2 целекоксиба — 0,7, хотя и больше, чем у рофекоксиба — 0,12 [22]. Исследование Hinz B. и соавт. (2003) показало, что после приема 100 мг ацеклофенака активность ЦОГ-2 в нейтрофилах человека блокируется более чем на 97%, в то время как активность «физиологической» ЦОГ-1 лишь на 46%. Для приема 75 мг диклофенака это соотношение было существенно хуже и составляло 97% и 82% соответственно [23].
Ацеклофенак обладает высокой биодоступностью, быстро и полностью всасываясь после перорального приема, при этом пиковая концентрация в плазме достигается через 1–3 часа. В человеческом организме он практически полностью метаболизируется в печени, основным его метаболитом является биологически активный 4-гидроксиацеклофенак, а одним из дополнительных, что интересно, диклофенак. В среднем через 4 часа половина препарата покидает организм, причем 70–80% экскретируется с мочой, а примерно 20% попадает в кал. Концентрация препарата в синовиальной жидкости составляет 50% от плазменной [22, 24].
Помимо основного фармакологического эффекта (блокады ЦОГ-2), для ацеклофенака доказано подавление синтеза важнейших провоспалительных цитокинов — таких как интерлейкин-1 (ИЛ-1) и фактор некроза опухоли (ФНО-альфа) [22]. Снижение ИЛ-1 — ассоциированной активации металлопротеиназ является одним из важнейших механизмов, которым определяется позитивное влияние ацеклофенака на синтез протеогликанов суставного хряща. Это свойство относится к числу главных достоинств этого препарата, поскольку служит дополнительным аргументом в плане целесообразности его использования при наиболее частом ревматологическом заболевании — остеоартрозе (ОА) [21, 24]. Масштабным подтверждением этого факта стало исследование Dingle J. (1999), в ходе которого было проанализировано влияние 13 различных НПВП на состояние хряща (650 проб, взятых у больных с ОА и в качестве контроля материал от 180 лиц без патологии суставов). Согласно полученным результатам, ацеклофенак был отнесен к числу препаратов, активно подавляющих катаболизм хрящевой ткани. Это особенно важно, учитывая тот факт, что для многих других н-НПВП — индометацина, ибупрофена и диклофенака in vitro показано отсутствие эффекта или даже негативное влияние на состояние суставного хряща [25].
Такие данные были получены, в частности, в исследовании Blot L. и соавт. (2000), материалом для которого послужили биоптаты медиального надмыщелка бедра от 40 больных умеренно выраженным или тяжелым гонартрозом. Хрящевая ткань была инкубирована с добавлением меченого глюкозамина в присутствии или отсутствии (контроль) ацеклофенака, мелоксикама и диклофенака. В дальнейшем с использованием анион-обменной хромотографии оценивалась концентрация хондроитина и гиалуроновой кислоты как маркеров активности хрящевого метаболизма. Согласно полученным результатам, диклофенак не оказывал значимого эффекта на метаболизм хряща, в то время как ацеклофенак и мелоксикам имели достоверно стимулирующее влияние [26].
Ацеклофенак применяется в клинической практике с конца 80-х годов, и по данным на 2004 г. им было пролечено более 75 млн человек в мире [18]. В настоящее время на фармакологическом рынке представлено 18 различных препаратов ацеклофенака: Aceclofar (AE); Aceflan (BR); Air-Tal (BE); Airtal (CL, ES, PT); Airtal Difucrem (ES); Aital (NL); Barcan (DK, FI, NO, SE); Beofenac (AT, DE); Berlofen (AR); Biofenac (BE, GR, NL, PT); Bristaflam (AR, CL, MX); Falcol (ES); Gerbin (ES); Locomin (CH); Preservex (GB); Proflam (BR); Sanein (ES); Sovipan (GR). В России ацеклофенак зарегистрирован с 1996 г. и используется под торговой маркой «Аэртал».
Доказательная база эффективности и безопасности ацеклофенака хорошо представлена в работе Dolley M. (2001). Эта работа является, вероятно, наиболее крупным метаанализом, оценивающим результаты 13 РКИ с активным контролем (n = 3574), а также наблюдательных, когортных и нерандомизированных исследований (суммарно 142746 больных). Доказана эффективность ацеклофенака в отношении выраженности боли при ревматических и неревматических заболеваниях, улучшение функции и повышение активности при остеоартрозе и дорсопатиях, а также влияние на число воспаленных суставов и утреннюю скованность при ревматоидном артрите и анкилозирующем спондилоартрите. При этом лечебное действие этого препарата не меньше, а в ряде ситуаций несколько выше, по сравнению с диклофенаком, кетопрофеном, ибупрофеном и напроксеном [24].
Наибольшее число хорошо организованных исследований эффективности и безопасности ацеклофенака связано с лечением ОА. При этом заболевании ацеклофенак успешно выдержал сравнение с парацетамолом, пироксикамом, напроксеном и диклофенаком (табл.).
Так, в недавней работе Batlle-Gualde E. и соавт. (2007), 168 больных ОА в течение 6 недель принимали ацеклофенак 200 мг/сутки или парацетамол 3 г/сутки. Исследование выявило несомненное преимущество ацеклофенака — снижение боли по ВАШ было больше на 7,6 мм, индекса Лекена на 1,6, отсутствие эффекта отмечалось лишь у 1 больного (при приеме парацетамола — у 8), р = 0,001. Суммарное число каких-либо нежелательных эффектов не различалось и составило 29% и 32% соответственно [27].
В 12-недельном РКИ Ward D. и сотр. (1995) было показано более высокое лечебное действие ацеклофенака в дозе 200 мг/сутки по сравнению с диклофенаком 150 мг/сутки у 397 больных ОА. Так, существенное (более 50%) уменьшение выраженности боли отмечалось у 71% и 59% больных (р = 0,005) соответственно. При этом неприятные симптомы со стороны ЖКТ достоверно реже возникали на фоне приема ацеклофенака, в частности, диарея возникла лишь у 1%, в то время как при терапии диклофенаком у 6,6% больных [28].
По результатам аналогичного по дизайну, длительности и размеру исследуемой группы (n = 374) исследования Kornasoff D. и сотр. (1997), ацеклофенак 200 мг был столь же эффективен, как напроксен 1000 мг/сутки в отношении выраженности боли и нарушения функции у больных гонартрозом. При этом нежелательные эффекты возникли у 12,6% и 16,3% больных соответственно [29].
Близкие данные были получены Perez Busquier M. и сотр. (1997). В этом 2-месячном РКИ (n = 240, больные с гонартрозом) лечебное действие ацеклофенака 200 мг/сутки оказалось аналогично эффекту пироксикама 20 мг/сутки. Однако диспепсия возникла у 24 и 33 больных, при этом у 7 больных, получавших пироксикам, нежелательные эффекты явились причиной отмены терапии, а у одного развилось опасное желудочно-кишечное кровотечение, в то время как серьезных осложнений на фоне ацеклофенака не было [30].
Ацеклофенак хорошо зарекомендовал себя при лечении ревматоидного артрита (РА). В работе Martin-Mele E. и сотр. (1998) эффективность этого препарата в дозе 200 мг/сутки сравнивалась с кетопрофеном 200 мг/сутки у 169 больных РА. В течение трех месяцев наблюдения оба препарата обеспечивали существенное снижение выраженности боли, улучшение общего самочувствия, при этом также было отмечено достоверное уменьшение выраженности артритов (снижение индекса Ричи) и длительности утренней скованности. Ацеклофенак был несколько более эффективен — лечение было прервано из-за неэффективности лишь у 4 больных, в то время среди принимающих кетопрофен — у 7. Очень важно, что ацеклофенак продемонстрировал лучшую переносимость, поскольку побочные эффекты стали причиной его отмены у 2 больных, по сравнению с 11 больными, получавшими препарат сравнения [31].
В работе Schaltenkircher M. и сотр. (2003) была изучена сравнительная эффективность ацеклофенака 200 мг/сутки и диклофенака 150 мг/сутки у 227 больных с болью внизу спины. Через 10 дней лечения среднее снижение выраженности боли было одинаковым: -61,6 и -57,3 мм по ВАШ соответственно. Однако полное излечение от боли отмечалось у 6 больных, принимавших ацеклофенак, и лишь у одного, получавшего диклофенак. При этом хотя бы один нежелательный эффект возник в группе ацеклофенака несколько реже, чем в контроле — 14,9% и 15,9% соответственно [32].
Эффективность ацеклофенака была показана не только при ревматических заболеваниях, но и при таком нередком патологическом состоянии, как дисменорея. Так, Letzel H. и сотр. (2006) показали, что однократное или повторное применение ацеклофенака столь же успешно купирует боли, как и напроксен 500 мг, существенно превосходя действие плацебо [33].
Возможность использования ацеклофенака в комплексной терапии послеоперационной боли была изучена на классической модели стоматологических манипуляций (экстракция зуба). В работе Presser Lima P. и сотр. (2006) было показано, что этот препарат оказывал эффективное обезболивающее действие, особенно в той ситуации, если первый прием проводился в режиме «предоперационной анальгезии», т. е. за 1 час до удаления зуба [34].
Наиболее крупным исследованием, посвященным изучению эффективности ацеклофенака в реальной клинической практике, стала европейская программа оценки удовлетворенности врачей и пациентов результатами анальгетической терапии (Lammel E. и сотр., 2002). Исследуемую группу составили 23 407 больных в Австрии, Бельгии, Голландии и Греции, испытывающих боли, связанные с ревматической патологией (РА, ОА, АС и дорсопатии), травмами и перенесенными операциями. Любопытно, что более половины из них были неудовлетворены предшествующей терапией НПВП, что явилось причиной для перехода на ацеклофенак. Длительность терапии и число визитов не лимитировались и определялись лечащими врачами исходя из клинической ситуации.
Результаты исследования были оценены его организаторами как превосходные. В конце периода наблюдения 85% больных оценили эффективность ацеклофенака как «очень хорошую», у 32% отмечалось полное купирование боли, а число пациентов, на момент включения оценивающих боль как «тяжелую», сократилось с 41% до 2% [35].
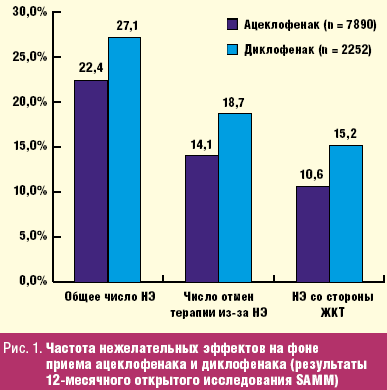
Фактически параллельно с работой Lammel E. и сотр. в Великобритании было проведено знаменитое исследование SAMM, целью которого было сравнительное изучение безопасности ацеклофенака в реальной клинической практике (контролем выступил диклофенак) (рис. 1). Ацеклофенак был назначен 7890, а диклофенак 2252 пациентам с РА, ОА и АС сроком на 12 месяцев. Исследование завершили 27,9% и 27,0% больных, средняя длительность приема НПВП составила около полугода. Полученные данные вполне оправдали надежды исследователей — ацеклофенак достоверно превосходил препарат сравнения по своей безопасности: суммарное число осложнений составило 22,4% и 27,1% (р < 0,001), из них со стороны ЖКТ 10,6% и 15,2% (р < 0,001). Отмены терапии из-за нежелательных эффектов также достоверно реже наблюдались на фоне приема ацеклофенака — 14,1% и 18,7% соответственно (р < 0,001). Угрожающие жизни осложнения со стороны ЖКТ (кровотечения, перфорации) возникли лишь у небольшого числа пациентов — 7 при использовании ацеклофенака и 4 на фоне приема диклофенака (разница недостоверна) [36].
Важнейшим доказательством относительно низкого риска опасных ЖКТ-осложнений при использовании ацеклофенака стали популяционные исследования (по типу случай-контроль) Laporte J. и сотр. (2004) и Lanas A. и сотр. (2006), проведенные в Италии и Испании [37, 7]. В обеих работах ацеклофенак демонстрировал наименьший риск развития желудочно-кишечного кровотечения по сравнению со всеми н-НПВП, а также мелоксикамом и нимесулидом. Так, в работе Lanas A., материалом для которой послужили данные о кровотечениях у 2777 больных (5532 составили контроль), поступивших в клиники Испании в 2002–2004 гг., относительный риск данного осложнения при использовании ацеклофенака составил 2,6 (1,5–4,6). Аналогичный риск при использовании диклофенака был 3,1 (2,3–4,2), ибупрофена 4,1 (3,1–5,3), напроксена 7,3 (4,7–11,4), кетопрофена 8,6 (2,5–29,2), индометацина 9,0 (3,9–20,7), пироксикама 12,6 (7,8–20,3) (рис. 2).
В настоящее время мы имеем мало данных, позволяющих оценить риск развития кардиоваскулярных осложнений, возникающих на фоне приема ацеклофенака. Пожалуй, единственным крупным анализом, посвященным данному вопросу, является масштабное исследование по типу случай-контроль, проведенное финскими учеными Helin-Salmivaara A. и сотр. (2006). Авторы оценили относительный риск инфаркта миокарда при использовании различных н-НПВП, оперируя данными о 33309 эпизодах этого опасного осложнения (138949 контроль). Ацеклофенак ассоциировался с более низким риском развития инфаркта миокарда — ОР 1,23 (0,97–1,62), чем индометацин — 1,56 (1,21–2,03), ибупрофен — 1,41 (1,28–1,55) и диклофенак — 1,35 (1,18–1,54) [38].
Оценивая изложенное, мы можем заключить, что ацеклофенак является представителем группы НПВП с убедительно доказанной в ходе серии хорошо организованных РКИ, а также длительных наблюдательных и когортных исследований, анальгетической и противовоспалительной активностью. По своему лечебному действию этот препарат не уступает и даже несколько превосходит такие популярные традиционные НПВП, как диклофенак, ибупрофен и кетопрофен, и значительно более эффективен, чем парацетамол. Ацеклофенак достоверно реже (на 20–30%) вызывает диспепсию, по сравнению с другими н-НПВП.
Кратковременные и небольшие по масштабу работы показывают существенно меньший ульцерогенный потенциал ацеклофенака (по данным Grau M., он в 2, 4 и 7 раз меньше, чем у напроксена, диклофенака и индометацина). Механизм лучшей ЖКТ-переносимости ацеклофенака не совсем ясен; некоторые авторы связывают его с отсутствием влияния на синтез ряда естественных компонентов защитного слоя слизистой желудка (в частности, гексозамина), а также усилением подслизистого кровотока [39].
С другой стороны, на настоящий момент автор не имеет четких данных о снижении риска опасных ЖКТ-осложнений (таких как кровотечения, перфорации и язвы) на фоне приема ацеклофенака; не демонстрирует это и масштабное наблюдательное исследование SAMM. К сожалению, нет информации о крупных сравнительных эндоскопических исследованиях ацеклофенака, позволяющих определить риск развития наиболее важного «суррогатного маркера» ЖКТ-осложнений — эндоскопических язв.
Однако мы располагаем важными данными, показывающими значительное снижение риска ЖКТ-кровотечений при использовании ацеклофенака, полученными в ходе двух масштабных ретроспективных популяционных исследований. Аналогичные результаты, отражающие реальную клиническую практику, были получены и в отношении снижения риска кардиоваскулярных осложнений.
Интересно, что согласно данным фармакоэкономического исследования, проведенного в Испании, существенное снижение риска различных нежелательных эффектов при относительно невысокой номинальной стоимости делает использование ацеклофенака в реальной клинической практике более выгодным, чем других популярных н-НПВП [40].
Большим достоинством ацеклофенака, в отличие от диклофенака и многих других представителей н-НПВП, представляется отсутствие негативного влияния на метаболизм суставного хряща, что делает целесообразным использование этого препарата для симптоматического лечения ОА.
К сожалению, в России имеются лишь единичные исследования (например, работа Гришаевой Т. П. и Балабановой Р. М.), посвященные собственному российскому опыту использования ацеклофенака [41]. На наш взгляд, этот препарат, несомненно, заслуживает более пристального внимания российских исследований, а также проведения крупных собственных работ, которые позволили бы более точно определить достоинства применения ацеклофенака у российских больных.
Тем не менее, на сегодняшний день ацеклофенак — доступный потребителю и качественный оригинальный препарат, со сбалансированным сочетанием анальгетической и противовоспалительной эффективности и хорошей переносимостью. В нашей стране, учитывая особенности фармакологического рынка, ацеклофенак вполне может претендовать на место лидера среди традиционных НПВП, используемых как для кратковременного, так и длительного лечения хронических заболеваний, сопровождающихся болью.
Таблица. Сопоставление достоинств и недостатков диклофенака и ацеклофенака: доказательная база
По вопросам литературы обращайтесь в редакцию.
А. Е. Каратеев, доктор медицинских наук
ГУ ИР РАМН, Москва









