Последнее десятилетие ознаменовано постоянным ростом количества биофармацевтических лекарственных средств (БЛС); по оценкам, к 2010 г. препараты, созданные на основе биотехнологий, составят около половины фармацевтических средств, получивших патенты. Первое поколение таких препаратов составляли продукты животного и растительного происхождения — бычий инсулин, стрептокиназа, стафилокиназа и др. Вслед за ними стали производить продукты человеческого происхождения, такие как гормон роста или антигемофильный фактор VIII. В последние десятилетия получены человеческие рекомбинантные продукты дезоксирибонуклеиновой кислоты (ДНК-продукты) — интерфероны γ, α и β, эритропоэтин (ЭПО), инсулин, гранулоцитостимулирующий фактор, гормон роста и ряд других. Первый человеческий белок (соматостатин), произведенный методом генной инженерии с использованием микроорганизмов (E. coli), был получен в 1977 г. Этот белок — гормон роста — предназначался для детей с его дефицитом. В 1978 г. создан рекомбинантный человеческий инсулин; в 1982 г. он стал первым биофармацевтическим препаратом, выпущенным на рынок. В 1981 г. разработан рекомбинантный интерферон γ, противовирусный препарат; в 1985–1986 гг. на рынок выведен рекомбинантный интерферон α — эффективное средство против вирусных инфекций, в частности хронических гепатитов (его также применяют в онкологии в качестве дополнительной терапии). В 1989 г. на фармацевтическом рынке появился первый препарат ЭПО для лечения ренальной анемии и анемии в онкологии, производимый в необходимых количествах овариальными клетками китайского хомячка. Таким образом, подавляющее большинство применяемых сегодня БЛС представляют собой рекомбинантные белки, полученные методом генной инженерии с помощью прокариотических клеток бактерий либо эукариотических клеток млекопитающих.
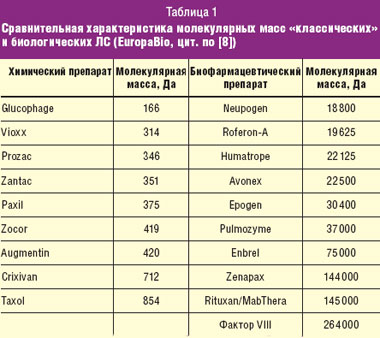
Истечение сроков патентной защиты оригинальных эпоэтинов стимулировали разработку новых версий этих продуктов, что способствует росту конкуренции и снижению цен. Окончание сроков действия патентов может стимулировать производителей инновационных продуктов на разработку и производство препаратов следующих поколений, но при этом существует опасность падения интереса к новаторству из-за возможного снижения прибыльности на фоне обостряющейся конкуренции. Появление аналогов БЛС ставит перед регуляторными органами задачу их контроля. Когда речь идет о традиционных фармпрепаратах, для вывода на рынок непатентованных дженерических лекарственных средств (ЛС) по упрощенной процедуре регистрации достаточно продемонстрировать их физико-химическое подобие и биологическую равноценность с помощью фармакокинетических и фармакодинамических исследований, проводимых на здоровых добровольцах. Такая концепция не применима по отношению к аналогам БЛС из-за трудности воспроизводства сложных белков, например таких, как ЭПО. Молекулы биологических ЛС отличаются значительно большими размерами по сравнению с веществами, полученными методом химического синтеза, и приобретают после трансляции третичную структуру. Такая молекулярная структура определяет функции этих веществ. В табл. 1 приводятся некоторые значения молекулярной массы для выборки биотехнологических препаратов в сравнении с классическими ЛС. Из таблицы видно, что в среднем молекулярная масса БЛС превосходит молекулярную массу химических препаратов в 100–1000 раз. У химических соединений конечный продукт представлен единой молекулой (или несколькими, но в очень небольшом числе), в то время как биопрепарат состоит из огромного числа смеси разных молекул. Такая смесь может быть высоковоспроизводимой при использовании мощной стандартизации и контроля на всех этапах производственного процесса, в то же время из-за сложности строения воссоздать точную копию биологического препарата практически невозможно, поскольку они не могут быть полностью «биотождественными», а только лишь «биоаналогичными». По тем же причинам невозможна адекватная характеристика биофармацевтических препаратов: невозможно адекватно охарактеризовать их с помощью существующих методов анализа.
Тем не менее в российском законодательстве до настоящего времени отсутствуют такие понятия, как «биофармацевтические» или «биологические» лекарственные средства и их «биоаналоги» [2], что не может не вызывать определенного беспокойства.
Успехи биотехнологий на примере лечения почечной анемии
Анемия при хронической болезни почек (ХБП) носит характер гипорегенераторный, нормохромный и нормоцитарный, со сниженным числом ретикулоцитов, и является полиэтиологичной патологией. Анемия особенно выражена и у пациентов на диализе: при отсутствии лечения уровень гемоглобина у 90% больных не превышает 10 г/дл. Основными причинами развития анемии при хронической почечной недостаточности (ХПН) являются недостаток выработки эндогенного ЭПО в почках, уменьшение срока жизни эритроцитов в условиях уремического окружения (гемолиз), дефицит железа. Таким образом, почечную анемию можно характеризовать как гипорегенераторную («ЭПО-дефицитную»), с признаками гемолиза и дефицита железа. Уремии свойственен как абсолютный, так и относительный дефицит эндогенного ЭПО. Концентрация ЭПО в крови больных ХПН значительно ниже, чем у больных с такой же тяжестью анемии другой этиологии. В лечении анемии широко применяются препараты рекомбинантного человеческого ЭПО (рчЭПО), которые в России используются с начала 1990-х годов [4]. Результаты рандомизированных контролируемых исследований показали, что их применение позволяет устранить анемический синдром и уменьшить потребность в гемотрансфузиях у пациентов как на преддиализной стадии, так и на стадии гемодиализа, снижает заболеваемость и смертность больных за счет сокращения сердечно-сосудистых и инфекционных осложнений, существенно повышает качество жизни и социально-трудовую реабилитацию данной категории больных [10]. Профилактика и коррекция анемии путем применения рчЭПО предотвращает и/или способствует обратному развитию гипертрофии миокарда левого желудочка, а также снижает увеличенный вследствие анемии сердечный выброс. Результаты метаанализа рандомизированных контролируемых исследований, проведенных с целью изучения эффективности применения рчЭПО у «преддиализных» и «диализных» пациентов, продемонстрировали, что использование препаратов рчЭПО способствует повышению уровня гемоглобина до рекомендуемых целевых значений (11–13 г/дл), а также снижению потребности в гемотрансфузионной терапии [3]. Применение рчЭПО, таким образом, радикально изменило не только подход к коррекции анемии почечного генеза, но и представление об адекватности заместительной терапии в целом.
Инновационные биопрепараты в лечении почечной анемии и их биоаналоги
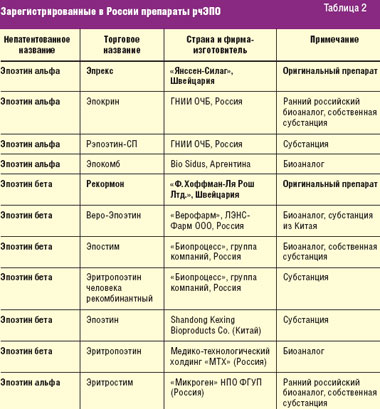
Длительное время в нашей стране использовались оригинальные БЛС — эпоэтин α и β и их первые российские аналоги, воспроизведенные еще в начале 1990-х годов. Включение в список ДЛО препаратов рчЭПО α и β, а также упрощенный порядок регистрации биоаналогов в России, не требующий обязательных клинических исследований эффективности, безопасности и иммуногенности в предрегистрационном периоде, привели к массовому выходу на российский рынок биоаналогов рчЭПО. Инновационные препараты эпоэтина α и β и их биоаналоги, зарегистрированные сегодня в РФ, представлены в табл. 2.
В ближайшие годы количество биоаналогов рчЭПО будет увеличиваться в связи с истечением срока патентной защиты оригинальных препаратов и сохраняющимся упрощенным порядком их регистрации. Наряду с отдельными весомыми преимуществами появления биоаналогов (низкая цена, доступность), особого внимания заслуживают вопросы безопасности их применения, поскольку биотехнологические препараты крайне сложно воспроизвести полностью биоэквивалентными.
Биологические, физиологические и общеклинические свойства БЛС в значительной степени зависят от процессов производства, очистки и приготовления лекарственных форм. Новаторы в области биофармацевтики приобретают опыт и накапливают данные, связанные с влиянием производственного процесса на конечный продукт, к которым у производителя биоаналога нет и не может быть доступа. Поэтому использование той же самой линии генетически однородных клеток и идентичных процессов производства, очистки и приготовления лекарственных форм не гарантируют того, что продукт будет являться биоэквивалентным исходному БЛС.
Так, ЭПО представляет собой гликопротеид с боковыми углеводными цепочками. Степень гликозилирования эпоэтина, в частности наличие свободных остатков сиаловой кислоты, изменяет его фармакокинетику и влияет на скорость выведения из организма. Кроме того, молекула ЭПО неоднородна — она состоит из смеси различных изоформ, что изначально обусловлено различиями в гликозилировании. Изоформный состав зависит от клеточных линий, условий развития культуры и процедур очистки, в результате чего возникают различные степени гликозилирования как в пределах одной клеточной линии, так и в разных линиях.
Различные изоформы ЭПО обладают разной биологической активностью [6]. Присутствие большего количества кислотных или щелочных изоформ может изменить активность ЛС. Щелочные изоформы связывают с уменьшенным периодом полувыведения.
Другая проблема, связанная с разработкой биоаналогов БЛС, — это повышение иммуногенности. Иммуногенность биофармацевтических веществ может возрастать за счет многих факторов, включая вариации последовательности технологических процессов, гликозилирования, наличия загрязняющих веществ и попадания примесей, имеют значение и приготовление лекарственных форм, хранение и погрузочно-разгрузочные работы.
Иммуногенность — это проблема особенно актуальная в случае эпоэтина, поскольку антитела к ЭПО оказывают нейтрализующее влияние на ЭПО, что приводит к прогрессирующей резистентной анемии вследствие развития истинной эритроцитарной аплазии костного мозга (PRCA). Кроме того, наличие загрязняющих веществ и попадание примесей, связанное с технологическим процессом, могут значительно изменить качество лекарства, его эффективность и профиль неблагоприятных событий.
Бразильские ученые и органы власти недавно занялись решением этой проблемы. Так, в результате проведенных проверок бразильское Управление надзора ANVISA приостановило ввоз двух препаратов рчЭПО от разных производителей [1]. Кроме того, последнее исследование, в процессе которого проводился анализ препаратов рчЭПО от разных производителей, показало различия между производственными партиями и обнаружило недопустимые уровни бактериальных эндотоксинов.
Исследования показывают, что продукты ЭПО производителей вне Европы и США сильно отличаются по составу [6–8]. Хотя это не обязательно означает, что данные продукты с клинической точки зрения уступают оригинальным препаратам, некоторые из них не соответствуют прилагаемым к ним спецификациям; такая ситуация указывает как минимум на то, что некоторые производители недостаточно качественно контролируют производственный процесс. Кроме того, содержимое ампул зачастую превышало допустимые показатели по указанной на этикетке активности [1]. Неправильная маркировка может привести к превышению дозировки и вызвать нежелательные клинические последствия.
Многие аналоги БЛС отличаются неоднородностью с точки зрения распределения изоформ. Поскольку трудно установить влияние разнообразных изоформ на общую степень активности и токсичности препарата, нормативные стандарты требуют соблюдения единообразия между различными партиями продукта. С учетом вышесказанного особую тревогу вызывает вариабельность различных партий одного и того же продукта. Несоответствие между партиями говорит о наличии крупных недостатков в производственном процессе или, что еще хуже, дает основание подразумевать разные источники того, что позиционируется как идентичный продукт.
Требования о получении разрешения на продажу биологических непатентованных препаратов производителями является предметом бурных споров, однако все чаще превалирует мнение, что подаваемые на утверждение документы должны содержать как клинические, так и биологические данные [1]. Глубина необходимых исследований, скорее всего, будет зависеть от сложности продукта, его действия, токсичности, возможного клинического эффекта, иммуногенности и возможности сравнения реакции у различных групп населения. Для того чтобы обнаружить редкие побочные явления, регистрация продукта должна быть связана с проведением пострегистрационных испытаний. Поскольку для многих биофармацевтических препаратов является обязательным постоянное хранение в охлажденных условиях на протяжении всей цепочки поставок от завода к пациенту, органы надзора и инспекции здравоохранения могут подвергнуть проверке систему дистрибуции нового поставщика.
Помимо требований к производству и дистрибуции следует учитывать, что биофармацевтические препараты, как правило, выписываются врачами, которые ожидают высокого уровня поддержки и медицинской информации со стороны компании, занимающейся продажей этих продуктов. Компании, подающие заявки на регистрацию непатентованных биологических препаратов, должны оцениваться в том числе по способности удовлетворения этих требований.
Следствием вышесказанного явилось существенное ужесточение правил регистрации биоаналогов в Европе и США: в 2006 г. EMEA (Европейское медицинское агентство) были утверждены новые требования к регистрации биоаналогов, включающие доклинические и клинические сравнительные исследования, а также дополнительный мониторинг нежелательных явлений в течение первого года применения в клинической практике [11].
В законодательстве Евросоюза понятие «биоаналог» рассматривается как продукт, не соответствующий понятию «дженерик», поскольку он представляет собой высокомолекулярный белок, и поэтому нет уверенности в его достаточном соответствии оригинальному продукту. В ЕС и США существует единое мнение о том, что ускоренная регистрация неприменима к аналогам БЛС [1]. В странах Евросоюза с 2006 г. все биоаналоги эпоэтина должны проходить полный цикл клинических испытаний перед своей регистрацией, включая фармакокинетические исследования на добровольцах, и как минимум два проспективных рандомизированных плацебо-контролируемых исследования отдельно с внутривенным и подкожным путями введения БЛС продолжительностью 6 мес и последующим анализом данных по иммуногенности в течение 12 мес [11].
Иммуногенность биоаналогов
Большинство БЛС индуцируют иммунную реакцию (иммуногенность), что, как правило, не приводит к клинически значимым последствиям. Однако в отдельных случаях последствия иммуногенности могут быть тяжелыми и даже летальными; они способны приводить не только к снижению эффективности препарата, но и вызывать аутоиммунные реакции к эндогенным молекулам.
В случае экзогенных белковых продуктов, таких как биофармацевтические продукты, экстрагированные из микробов, растений или животных, возникновение иммунной реакции на чужеродные белки вызывает образование нейтрализующих антител. Медиатором иммунного ответа выступают Т-клетки; иммунный ответ проявляется как незамедлительная реакция после первой встречи с антигеном.
При иммунном ответе на эндогенные человеческие белки (аутоантиген), например рекомбинантные ДНК-продукты, происходит образование связывающих антител. Ответ такого рода опосредуется Т-клетками через снижение иммунной толерантности, реакция возникает быстро и исчезает после прекращения терапии.
Теоретически основой иммуногенности к биофармацевтическим ЛС является их чужеродность, экзогенное происхождение либо подобие собственным антигенам. В обоих случаях клинические симптомы иммуногенности проявляются после активации секретирующих антитела В-клеток.
Существует два механизма возникновения иммуногенности. Во-первых, посторонние включения в биофармацевтическом продукте (например, эндотоксины или денатурированные белки) посылают вторичный сигнал (так называемый сигнал об опасности) Т-клеткам, которые затем посылают сигнал о начале активации В-клеткам, в результате чего нарушается иммунологическая толерантность последних.
Во-вторых, толерантность В-клеток может нарушаться вследствие независимого ответа со стороны Т-клеток. Так, если биофармацевтический продукт не обладает способностью равномерно растворяться, он может образовывать агрегаты. Иммунная система может ошибочно принять подобные агрегаты за вирусы, вследствие чего происходят активация и пролиферация В-клеток с продукцией аутореактивных связывающих антител [7].
Факторы, влияющие на иммуногенность
Факторы, связанные с препаратом. Известны связанные с продуктом и «хозяином» факторы, вызывающие иммуногенность БЛС. К ним относят следующие: структурные особенности (например, последовательность белков), наличие экзогенных или эндогенных эпитопов и степень гликозилирования, влияющая на деградацию белка, воздействие на антигенные участки и растворимость препарата. Самая высокая иммуногенность интерферона α-2 (ИФН α-2), получаемого из клеток Escherichia coli, была связана с недостаточным гликозилированием по сравнению с другими продуктами, экстрагированными из CHO-клеток (овариальных клеток китайского хомячка). Другими факторами, влияющими на иммуногенность, являются форма выпуска, условия хранения, технология производства и выделения продукта, недостаточная его очистка и наличие радионуклидных примесей. Доказательство важности указанных факторов — многочисленные зарегистрированные случаи, связанные с антигенностью препаратов ИФН α-2 от разных производителей. Было показано, что изменяя форму выпуска и условия хранения ИФН α-2, можно снизить его иммуногенность.
Факторы, связанные с «хозяином». На иммуногенность биофармацевтических продуктов влияют несколько факторов, связанных с «хозяином». Генетические особенности пациента могут приводить к образованию нейтрализующих антител. Так, аллель основного комплекса гистосовместимости влияет на способность «хозяина» распознавать антиген в реакциях, медиаторами которых являются Т-клетки. Одновременно важным фактором может оказаться генетическая последовательность с кодом эндогенного эквивалента терапевтического протеина.
В ряде работ было показано, что вероятность возникновения иммуногенности у пациентов с гемофилией А, которым назначался фактор VIII, зависит от эндогенной экспрессии белка. При разрушении фактора VIII он воспринимался как чужеродный и вызывал продукцию нейтрализующих его антител. Такая ситуация возникает значительно реже при генетических мутациях молекулы белка.
На иммуногенность могут также влиять сочетанные заболевания пациентов, особенно заболевания почек и печени. При аутоиммунных заболеваниях организм предрасположен к продукции антител к терапевтическим протеинам.
Важными факторами являются дозировка и путь введения препарата. При повышенной дозировке и более продолжительном курсе лечения повышается риск развития иммуногенности. Иммуногенность повышается в том случае, когда БЛС назначается подкожно и внутримышечно, и снижается при внутривенном и локальном назначении [7].
Продолжение читайте в следующем номере.
В. Ю. Шило, кандидат медицинских наук
Центр диализа при ГКБ № 20, Москва









