Нарушение акта мочеиспускания — одна из наиболее частых жалоб, являющихся основанием для обращения к урологу. Следует отметить, что распространенность расстройств мочеиспускания прямо пропорциональна возрасту больного, и наиболее подвержены подобным расстройствам пациенты старше 50 лет. Изменение демографической ситуации во всем мире и в нашей стране, характеризующееся увеличением числа лиц старшего возраста, выводит расстройство мочеиспускания в ряд первоочередных медицинских и социальных проблем.
Начало 90-х годов прошлого века ознаменовалось резким повышением интереса урологов всего мира к проблеме медикаментозной терапии расстройств мочеиспускания, обусловленных заболеваниями нижних мочевых путей. На фоне всего многообразия лекарственных препаратов для коррекции расстройств мочеиспускания группа селективных α1-адреноблокаторов уверенно заняла лидирующие позиции.
Исследование популярности различных лекарственных препаратов для медикаментозной терапии доброкачественной гиперплазии предстательной железы (ДГПЖ) в условиях реальной клинической практики было выполнено в 2003 г. в шести странах Европы. Проект продолжался в течение года, включал более 5 000 пациентов и получил название TRIUMPH. [5] При анализе данных выявлено, что у 30% пациентов в качестве оптимального варианта ведения было выбрано динамическое наблюдение. Среди больных, получавших консервативную терапию, распределение препаратов оказалось следующим: 16% — блокаторы 5-α-редуктазы, 79% — α-адреноблокаторы, 5% — растительные экстракты. Эти данные полностью отражают тенденцию к снижению популярности растительных препаратов, не рекомендованных к назначению Европейской асcоциацией урологов у больных ДГПЖ [10].
В настоящее время существуют объективные доказательства эффективности лечения различных расстройств мочеиспускания с помощью α1-адреноблокаторов. Причины широкого распространения препаратов этой фармакологической группы становятся очевидны при рассмотрении механизмов их действия. В основе патогенеза нарушения акта мочеиспускания у большинства урологических больных лежат недостаточность энергетического метаболизма и гипоксия детрузора в условиях повышенного уретрального сопротивления. Работами сотрудников нашей кафедры доказано, что в мышечной ткани мочевого пузыря при нарушенном акте мочеиспускания наблюдаются уменьшение артериовенозной разности парциального напряжения кислорода и метаболический ацидоз, а также снижение активности ферментов в ткани детрузора, участвующих в ключевых реакциях анаэробного окисления. Параллельно с вышеописанным в отмечается процесс повышения активности гликолитических ферментов и ферментов пентозофосфатного шунта, свидетельствующих о преобладании в детрузоре гликолиза [1].
Причины нарушений энергетического метаболизма и функции детрузора крайне многообразны. В частности, они могут возникать при повышении активности симпатической нервной системы, расстройствах органного кровообращения, авитаминозе (группа В), хронических заболеваниях дыхательной и сердечно-сосудистой систем, а также усугубляться под влиянием приема ряда фармакологических препаратов, угнетающих дыхательную цепь и вызывающих обструктивные нарушения уродинамики [1].
Гистологические признаки ДГПЖ определяются у большинства мужчин старше 40 лет [6]. В начале отмечается появление стромальных узелков в периуретральной области переходной зоны простаты. После узлообразования возникает железистая гиперплазия простаты. Клинически данное заболевание проявляется различными симптомами, связанными с нарушением пассажа мочи по нижним мочевым путям (необходимость просыпаться ночью, чтобы опорожнить мочевой пузырь, уменьшение напряжения струи мочи, ощущение неполного опорожнения мочевого пузыря после мочеиспускания и наличие трудно сдерживаемых позывов к мочеиспусканию). Зачастую к вышеперечисленным симптомам присоединяется затруднение в начале акта мочеиспускания, более выраженное утром и заставляющее пациентов натуживаться. Все вышеперечисленные симптомы зачастую объединяются общим названием — «симптомы нижних мочевых путей» (СНМП). При отсутствии адекватного лечения на конечных стадиях заболевания резко возрастает риск возникновения острой задержки мочи и почечной недостаточности.
Механизм воздействия α1-адреноблокаторов у больного ДГПЖ основан на блокаде передачи нервных импульсов в симпатической нервной системе и расслаблении гладкой мускулатуры «заинтересованной» зоны, что, в свою очередь, вызывает снижение внутриуретрального сопротивления и улучшение кровоснабжения органов малого таза [2].
В последние годы медикаментозная терапия ДГПЖ α1-адреноблокаторами стала международным стандартом [1, 3]. Популярность этих лекарственных препаратов заметно выше по сравнению с блокаторами 5-α-редуктазы и препаратами растительного происхождения [4, 5].
Исследования последних лет свидетельствуют, что у больных ДГПЖ в нижнем отделе мочевого тракта протекают два параллельных процесса — формирование уретральной обструкции и нарушение энергетического метаболизма детрузора (митохондриальная недостаточность). Причиной обструкции является увеличение простаты в размерах с постепенным сужением просвета мочеиспускательного канала (механический компонент) и повышением тонуса гладкомышечных волокон простаты и задней уретры (динамический компонент) [1, 6].
Альфа-адреноблокаторы устраняют гипертонус гладкой мускулатуры стромы предстательной железы, занимающей до 60% объема гиперплазированной простаты, что позволяет уменьшать динамический компонент инфравезикальной обструкции [7]. Кроме того, доказанное в экспериментах улучшение кровоснабжения мочевого пузыря, имеющее место на фоне лечения α-адреноблокаторами, приводит к улучшению биоэнергетики детрузора и восстановлению его сократительной способности [1].
Многими международными сравнительными мультицентровыми исследованиями было доказано, что на фоне лечения α1-адреноблокаторами у пациентов с ДГПЖ уменьшается симптоматика (в среднем на 50%), возрастает максимальная объемная скорость мочеиспускания (на 30–47%), а количества остаточной мочи сокращается вдвое [8, 9].
В настоящее время в России доступны несколько α1-адреноблокаторов: альфузозин, теразозин, доксазозин и тамсулозин. Сравнительные исследования этих препаратов, проводившиеся во многих урологических клиниках мира, доказали их практически равную эффективность [9, 10]. Вопрос подбора оптимальной терапии внутри этой фармакологической группы в последние годы перестал определяться степенью воздействия лекарственного средства на симптоматику ДГПЖ, а зависит в основном от вероятности возникновения побочных эффектов, удобства применения, доступности препаратов и индивидуальных предпочтений врача.
Многочисленные клинические исследования доказали, что наибольшая частота побочных эффектов регистрируется на фоне терапии доксазозином и теразозином — препаратами, требующими титрования и доставшимися урологам «в наследство от терапевтов». Действительно, первые опыты применения α1-адреноблокаторов в урологии в начале 80-х годов прошлого века основывались на эмпирических данных, свидетельствующих об улучшении качества мочеиспускания у больных, получавших эти препараты в связи с гипертонической болезнью. Безусловно, в урологии они применяются в меньших дозировках, но их гипотензивный эффект по-прежнему проявляет себя большим количеством побочных эффектов. Возникновение различных по интенсивности нежелательных явлений на фоне лечения регистрируется у 10–16% пациентов [10, 14]. В основе механизма возникновения вышеуказанных побочных явлений лежит воздействие препаратов на гладкую мускулатуру сосудистой стенки, приводящее к вазодилатации и опасности депонирования крови на периферии, особенно при резкой перемене положения тела после длительного пребывания в горизонтальном положении.
В исследовании R. E. Eckert в 1999 г. было доказано, что отношение концентрации препарата, блокирующего 50% адренорецепторов почечной артерии и простаты, оказалось наиболее выгодным у альфузозина. Таким образом, клиническая селективность альфузозина (Дальфаз) значительно превосходит таковую у прочих представителей группы α1-адреноблокаторов [11] (рис. 1). Соотношение для различных препаратов оказалось следующим: альфузозин (543,59) > тамсулозин (89,81) > доксазозин (50,75) > теразозин (18,65).
Полученные данные противоречили распространенному мнению, согласно которому наибольшей уроселективностью обладает тамсулозин, избирательно блокирующий α1-адренорецепторы в ткани простаты. Стало очевидным, что фармакологическая уроселективность далеко не всегда совпадает с клинической. Неоднозначное понимание селективности в отношении различных α1-адреноблокаторов явилось основанием для формулировки нескольких понятий.
- Фармакологическая уроселективность — афинность к α1-адренорецепторам или к какому-нибудь из их подтипов.
- Функциональная уроселективность — способность вызывать релаксацию уретры с минимальным воздействием на сердечно-сосудистую и центральную нервную системы.
- Клиническая уроселективность — показатель, характеризующий влияние препаратов на инфравезикальную обструкцию (ИВО) и симптомы нижних мочевых путей (СНМП) при минимальном количестве побочных эффектов. Клиническая уроселективность — самый важный критерий, определяющий соотношение выгоды и риска применения препарата.
В 2001 г. C. G. Roehrborn было предпринято еще одно исследование, задачей которого было сравнение уроселективности различных α1-адреноблокаторов. Результаты его оказались очень похожи на предыдущие: наибольшую клиническую селективность продемонстрировал альфузозин, несколько меньшую — тамсулозин. У прочих препаратов уровень простатоселективности оказался значительно ниже [12] (рис. 2).
Проведенное в 2006 г. сравнительное исследование эффективности и безопасности тамсулозина (OCAS“) и альфузозина (Дальфаз CР) — двух препаратов с замедленной формой высвобождения — продемонстрировало абсолютно равную частоту возникновения побочных эффектов, связанных с сердечно-сосудистой системой. В абсолютном выражении риск возникновения подобных эффектов был очень низким у обоих препаратов [13]. Проведенные на животных исследования показали, что альфузозин обладает весьма высокой избирательностью и специфичностью действия на α1А-адренорецепторы, которое в 40 раз превосходит его влияние на α1В-адренорецепторы [17].
Говоря о расстройстве мочеиспускания у пожилых мужчин, ДГПЖ и СНМП, нельзя не сказать и о расстройстве сексуальной функции. Это зачастую не самостоятельное заболевание, а проявление различных нарушений в организме мужчины. Распространенность и выраженность эректильной дисфункции четко коррелирует с возрастом (как и ДГПЖ) и составляет в 50 лет около 50%, в 60 лет — 60%, в 70 лет — 70%. При этом больные с симптомами нарушения акта мочеиспускания составляют 72,2% пациентов с эректильной дисфункцией [15]. Внутри одной возрастной группы частота встречаемости сексуальных расстройств прямо пропорциональна выраженности СНМП [16].
Данные нескольких международных исследований эффективности применения α1-адреноблокаторов свидетельствуют, что наряду с уменьшением выраженности СНМП, многие пациенты отмечают улучшение половой функции [16]. Предполагается, что причиной подобного эффекта является поливалентный механизм действия α-адреноблокаторов, вызывающий улучшение кровообращения органов малого таза и общее повышение качества жизни больного. На кафедре урологии МГМСУ с 1990 г. ведется работа по изучению эффективности и безопасности лечения СНМП у мужчин. Общее число пациентов, получавших с этой целью α1-адреноблокаторы, — около 2200 человек. Среднее улучшение качества жизни, измерявшееся нами при помощи вопросника QОL, составило 32%. Положительные изменения общего статуса пациента, уменьшение выраженности СНМП и улучшение показателя качества жизни и кровообращения в области малого таза выражаются улучшением показателей сексуальной активности пациентов. Исследования в этом направлении продолжаются.
На основании данных международных исследований, показателей клинической эффективности и накопленного опыта нашей кафедры наиболее часто назначается препарат альфузозин (Дальфаз).
Выпуск лекарственной формы с замедленным высвобождением (Дальфаз СР) позволил устранить пики сывороточной концентрации, связанные с приемом препарата, обеспечить постоянный уровень препарата в крови и тем самым дополнительно снизить риск развития побочных эффектов. В настоящее время на кафедре урологии МГМСУ имеется опыт его применения более чем у 1 600 пациентов с ДГПЖ.
Дальфаз-ретард в дозировке по 5 мг 2 раза в день или 10 мг 1 раз в день был применен нами у 1200 пациентов (средний возраст 64,5 года), страдающих ДГПЖ. Первую дозу препарата пациенты принимали вечером. Все пациенты отвечали стандартным рекомендациям ВОЗ по критериям включения и исключения для назначения лекарственной терапии ДГПЖ.
После первого года непрерывной терапии улучшение качества мочеиспускания было отмечено у 87% пациентов. К окончанию первого года лечения суммарный балл IPSS уменьшился на 39%, а балл QOL — на 29%. Максимальная скорость потока мочи увеличилась на 45% к окончанию первого года лечения и стабилизировалась на достигнутом уровне. На фоне улучшения симптоматики отмечено постепенное увеличение объема простаты (в среднем на 2–4% в год) и возрастание уровня простатспецифического антигена сыворотки крови (на 4,5% в год). За время лечения возникновение тех или иных побочных эффектов отмечено у 5,7% пациентов. Наиболее частыми побочными эффектами были: жалобы на головную боль (1,6%), головокружение (0,5%) и снижение систолического артериального давления не более чем на 5 мм рт. ст. (0,5%). Причина возникновения подобных жалоб, вероятно, кроется в воздействии α1-адреноблокаторов на тонус сосудистой стенки, что закономерно, если учесть механизм их действия [1, 10, 14].
Согласно статистическому анализу, показатель эффективности равномерно распределен во всех возрастных группах больных, т. е. эффективность препарата Дальфаз не зависит от возраста пациента.
Одним из перспективных направлений применения α-адреноблокаторов у больных ДГПЖ является назначение их в комбинации с ингибиторами 5-α-редуктазы, ряды которых пополнились за последний год новым препаратом дутастерид (Аводарт). Данное сочетание воздействует на все компоненты патогенеза ухудшения качества мочеиспускания у больных ДГПЖ и позволяет существенно улучшить результаты медикаментозного лечения данного заболевания.
Опубликованное в 2003 г. исследование MTOPS (Medical Therapy of Prostate Symptom) в настоящее время является наиболее длительным и репрезентативным исследованием эффективности и безопасности комбинированной медикаментозной терапии ДГПЖ, доказавшим перспективность такого сочетания. Влияние комбинированной терапии на риск прогрессии ДГПЖ было оценено на протяжении 4 лет наблюдения на основании анализа результатов лечения 3 047 больных ДГПЖ. По данным MTOPS, наилучшие результаты были достигнуты именно в группе комбинированной терапии — риск прогрессирования заболевания снизился на 67%. У 69% больных отпала необходимость в оперативном лечении. Риск развития острой задержки мочеиспускания был снижен на 79%. После комбинированной терапии, наименьший риск прогрессии отмечен в группе монотерапии α1-адреноблокатором. Чуть хуже этот показатель в группе монотерапии финастеридом (Финаст) [18, 19].
Вместе с тем важно отметить, что комбинированная терапия является довольно затратным вариантом лечения, и количество побочных эффектов, регистрируемых на ее фоне, превышает таковые в группах монотерапии. Несмотря на доказанную эффективность, популярность комбинированной терапии в мире пока невелика.
Учитывая высокую эффективность и малое количество побочных эффектов, селективные α1-адреноблокаторы в последние годы стали препаратами выбора в медикаментозной терапии ДГПЖ. Они применяются в лечении пациентов со слабой или умеренно выраженной симптоматикой, а также у пациентов, ожидающих операцию или желающих избежать хирургического вмешательства.
Литература
- Вишневский А. Е. Нарушения энергетического метаболизма в патогенезе расстройств мочеиспускания у больных доброкачественной гиперплазией простаты и обоснование их медикаментозной коррекции: автореф. дис. ... д-ра мед. наук. М., 2007.
- Сивков А. В., Аполихин О. И., Патаки К. В. Современный алгоритм обследования и лечения больных доброкачественной гиперплазией предстательной железы // Consilium medicum. 2004. № 7. Т. 6. С. 516–535.
- Chapple C. Alphα-blocker update — prostate-selective blockade. Curr. Opin. Urol. 1997; 7: 8–14.
- McNicholas Lower Urinary Tract Symptoms Suggestive of Benign Prostatic Obstruction: What Are the Current Practice Patterns/ Eur.Urol. 2001; 39(suppl 3): 26–30.
- The Efficacy of Drugs for the Treatment of LUTS/BPH, A Study in 6 European Countries, Hutchison A, Farmer R, Verhamme K, Berges R, Navarrete RV, Reich O, de la Rosette JJMCH European Urology January 2007. 51, Issue 1: 207–216.
- Lepor H. Pathophysiology, epidemiology and natural history of benign prostatic hyperplasia. Rev in Urol 2004;6 (Suppl 9): 310.
- Shapiro E., Hartanto V., Lepor H. Quantifying the smooth muscle content of prostate using double-immunoenzymatic staining and color assisted image analysis. J. Urol., 1992. 147. 1167–1170.
- Lukacs B., McCarthy C., Grande J. C. and the QOL BPH Study Groupin General Practice. Long term quality of life in patients with with benign prostatic hypertrophy: preliminary results of a cohort survey of 7093 patients treated with alpha1 blocker, alfuzosin. Eur. Urol. 1993. 24 (suppl. 1). 34–40.
- Irani J. Are All Alphα-Blockers Created the Same? European Urology March 2006. 49, Issue 3, 420–422.
- EAU 2004 Guidelines on Assessment, Therapy and Follow-Up of Men with Lower Urinary Tract Symptoms Suggestive of Benign Prostatic Obstruction (BPH Guidelines) Madersbacher S, Alivizatos G., Nordling J., Sanz C. R., Emberton M., de la Rosette JJMCH European Urology November 2004. 46, Issue 5, 547–554.
- R. E. Eckert et al. Prostate selectivity of alpha1-adrenoceptors blockers. J. Urol. 1999; 161 (Suppl): 163.
- Roehrborn C. G. Alfuzosin: overview of pharmacokinetics, safety, and efficacy of a clinically uroselective alphblocker. Urology. 2001 Dec;58(6 Suppl 1): 55–63; discussion 63–4. Review.
- Comparison of the Cardiovascular Effects of Tamsulosin Oral Controlled Absorption System (OCAS(r)) and Alfuzosin Prolonged Release (XL). Michel MC, Chapple CR European Urology March 2006. 49, Issue 3, 501–509.
- Chapple C. Selective α1-adrenoceptor antagonists in benign prostatic hyperplasia: rationale and clinical experience. Eur.Urol. 1996; 29: 129–144.
- Braun M, Wassmer G, Klotz T, Reifenrath B, Mathers M., Engelmann U. Epidemiology of erectile dysfunction: results of the ‘Cologne Male Survey’. Int. J. Impot Res. 2000 Dec;12 (6): 305–11.
- Tubaro A., Polito M., Giambroni L., Famulari C., Gange E., Ostardo E. Sexual function in patients with LUTS suggestive of BPH. Eur Urol. 2001; 40 Suppl 1: 19–22.
- Buzelin J.M., Delauche-Cavallier M.C., Roth S. et al. Clinical uroselectivity: Evidence from patients treated with slow-release alfuzosin for symptomatic benign prostatic obstruction. Br. J. Urol 1997. 79. 898–906.
- Djavan B, Barkin J. Novel therapeutic strategies for managing BPH progression. Eur Urol 2003;(Suppl. 2): 20–26.
- McConnell J. D. For the MTOPS Research Group. The long term effect of doxazosin, finasteride and combination therapy on the clinical progression of benign prostatic hyperplasia. N Eng J Med 2003; 349: 2385–96.
Д. Ю. Пушкарь, доктор медицинских наук, профессор
П. И. Раснер, кандидат медицинских наук
МГМСУ, Москва
Приложения
-
- Терапия α-адреноблокаторами у больных ДГПЖ - Рис. 1.
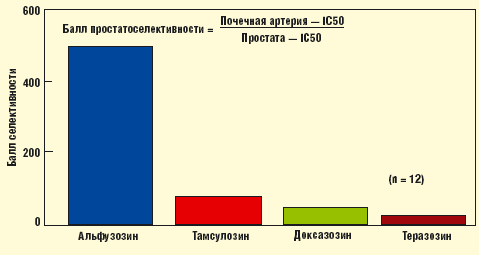
Отношение концентрации препарата, необходимого для блокады 50% адренорецепторов почечной артерии и ткани простаты [11]
-
- Терапия α-адреноблокаторами у больных ДГПЖ - Рис. 2.
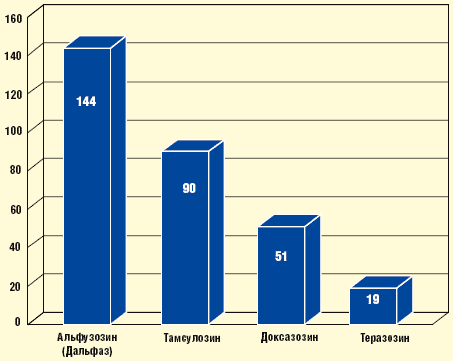
Соотношение селективности ткань простаты/ткань сосудов









