Ежегодно у 200 млн женщин в мире наступает беременность, у 137,6 млн из них она заканчивается родами. Каждый год около 585 тыс. женщин умирает от причин, связанных с беременностью [6].
В Российской Федерации гестоз и эклампсия занимают одно из первых трех мест в структуре материнской смертности, периодически уступая первенство кровотечениям и септическим осложнениям. В последние годы отмечается увеличение частоты гестоза за счет тяжелых форм патологии. Эклампсия — крайне опасное осложнение гестоза, встречается достаточно часто: 1 случай на 2000 родов в Европе и развитых странах [16]. В развивающихся странах в среднем 1 случай эклампсии приходится на 100 родов, что в 20 раз чаще, чем в странах с высоким социальным уровнем жизни.
В мире ежегодно от эклампсии или связанных с нею осложнений погибает около 50 тыс. женщин. В отдельных странах уровень материнской смертности при эклампсии достигает 17,5%, а перинатальной смертности — от 13 до 30% [11]. Таким образом, становится очевидным тот факт, что существенного прогресса в осмыслении этиологии, патогенеза, а следовательно, и профилактики гестоза за последние несколько десятков лет не произошло. Отечественными и зарубежными авторами [4, 7, 20, 32] убедительно доказано, что классическая триада симптомов не является достоверным прогностическим критерием, а имеющиеся методы диагностики гестоза имеют ряд существенных для практической деятельности недостатков: невысокий прогностический индекс, отсутствие должной степени воспроизводимости, высокую стоимость. В связи с этим по-прежнему актуален поиск критериев тяжести гестоза, отличающихся высокой степенью корреляции с развитием тяжелых, жизнеопасных осложнений, а также характеризующихся достаточной воспроизводимостью для применения их в условиях скрининговых исследований, неинвазивностью, низкой стоимостью.
Впервые в нашей акушерской практике внедрен метод транскраниальной допплерографии (ТДГ) для оценки состояния мозгового кровообращения у беременных и рожениц с гестозом. Установлены нормативные величины отдельных показателей мозгового кровообращения у здоровых беременных и рожениц. Выявлены дополнительные критерии значимости в диагностике тяжести гестоза.
Целью настоящего исследования была оценка мозгового кровообращения у беременных и рожениц с гестозом. При этом решались следующие задачи:
- изучение перфузии мозга у беременных и рожениц с различной степенью тяжести гестоза;
- установление взаимосвязи между мозговым кровообращением и отдельными критериями, определяющими тяжесть гестоза;
- выявление дополнительных прогностических критериев тяжести гестоза.
Исследование проводилось на базе Республиканского перинатального центра Министерства здравоохранения Республики Карелия. Под наблюдением находились 232 женщины в возрасте от 16 до 37 лет (средний возраст 25,2 ± 5,5 года) с диагнозом гестоза различной степени тяжести. Группу сравнения составили 90 условно здоровых беременных женщин в возрасте от 19 до 34 лет (средний возраст 25,9 ± 4,2 года) в третьем триместре беременности, состоявших на диспансерном учете в консультативном отделении перинатального центра. Беременные основной группы были разделены на три подгруппы: в первую подгруппу входили 110 пациенток с гестозом легкой степени тяжести, во вторую — 70 женщин с гестозом средней степени тяжести, в третью — 52 пациентки с тяжелым гестозом. Средний гестационный возраст в обеих группах составил 34 ± 3 нед. Динамическое наблюдение в послеродовом периоде проводилось на вторые сутки. Диагноз гестоза был верифицирован на основании Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра. Степень тяжести гестоза оценивалась по шкале Goecke в модификации Г. М. Савельевой. Все женщины находились на лечении в отделении патологии беременности или палате интенсивной терапии перинатального центра. В клинически тяжелых случаях детальное обследование осуществлялось после начала терапии. Из наблюдения были исключены пациентки, имеющие пороки сердца, нарушения сердечного ритма, ишемическую болезнь сердца, хроническую артериальную гипертензию, кардиомиопатию, грубые нарушения гемореологических показателей, сахарный диабет, нейроинфекции, черепно-мозговые травмы и эпизоды синкопальных состояний в анамнезе.
Артериальное давление (АД) измерялось в положении на левом боку автоматическим сфигноманометром монитора Cardiocap II фирмы DATEX, с обычной манжетой на левой руке, дважды — до и после ТДГ. Среднее артериальное давление (САД) подсчитывали по формуле Хикема: САД = дАД – пАД В 3, где дАД — диастолическое артериальное давление, пАД — пульсовое артериальное давление, согласно равенству пАД = сАД – дАД, где сАД — систолическое артериальное давление.
Состояние центральной гемодинамики исследовали методом двухмерной эхокардиографии. Сканограммы записывались в плоскости, перпендикулярной анатомической оси сердца, на уровне папиллярных мышц в парастернальной позиции. Регистрация производилась в фазах систолы и диастолы путем синхронизации с электрокардиографией во втором стандартном отведении. Показатели электрокардиограммы определялись с помощью неинвазивного метода монитором Cardiocap II фирмы DATEX.
Парастернальным доступом в M-режиме в фазе систолы вычислялся конечно-систолический размер (КСР), в фазе диастолы — конечно-диастолический размер (КДР), установлена частота сердечных сокращений (ЧСС). На основании полученных данных встроенной программой ультразвукового сканера автоматически вычисляли по L.Teichholz конечно-систолический объем (КСО) левого желудочка, конечно-диастолический объем (КДО) левого желудочка. Подсчитаны ударный объем (УО): УО = КДО – КСО; фракция выброса (ФВ): ФВ = УО В КДО х 100 (%) , фракция укорочения (ФУ) переднезаднего размера левого желудочка в систолу: ФУ = {(КДР – КСР) В КДР} Ё 100 (%); минутный объем сердца (МОС): МОС = (УО х ЧСС) В 100; сердечный индекс (СИ): СИ = МОС В ППТ. Подсчет сердечного индекса потребовал вычисления площади поверхности тела (ППТ) согласно равенству DuBois: ППТ = 0,007184 х Р0,725 х В0,425, где Р — рост в сантиметрах, В — вес в килограммах. Общее периферическое сопротивление сосудов (ОПСС) подсчитывали по установленной формуле: ОПСС = САД х 80 В МОС.
Церебральная гемодинамика изучалась с помощью метода ТДГ. Исследование выполнялось на ультразвуковом сканере Aloka SSD–4000, в положении на спине с 15° наклоном влево для предупреждения развития синдрома аорто-кавальной компрессии. С целью исключения патологии, оказывающей потенциальное воздействие на фоновые показатели церебрального кровотока, проводилось цветовое дуплексное сканирование брахиоцефальных артерий и артерий вертебробазилярного бассейна.
При ТДГ транстемпоральным доступом с обеих сторон измерялись количественные параметры кровотока в области M1 сегмента средней мозговой артерии: пиковая систолическая скорость кровотока (PSV), конечная диастолическая скорость (EDV), усредненная по времени средняя скорость (TAV), индекс стабильности потока (SFI), систоло-диастолическое отношение (S/D), пульсационный индекс (PI) и индекс резистентности (RI). Перечисленные величины подсчитывались автоматически встроенной программой ультразвукового сканера.
Поскольку указанные выше линейные характеристики допплеровского спектра не позволили составить объективное представление об объеме перфузии мозга, был подсчитан ряд показателей, анализ которых помог уточнить состояние церебральной гемодинамики. По формуле K. P. Williams и соавторов [33] вычислялся индекс мозгового кровотока (BFI): BFI = CPP В RAP, где CPP — церебральное перфузионное давление, RAP — индекс гидродинамического сопротивления. CPP подсчитывали по формуле R. Aaslid в модификации M. A. Belfort и соавторов [28]: CPP = TAV В (TAV – EDV) х (CAД – дАД). После подсчета BFI и CPP появилась информация для объективного анализа перфузии мозга. Измерение внутричерепного давления (ICP), роль которого существенна в понимании ряда патофизиологических механизмов системы ауторегуляции сосудистого тонуса интракраниальных артерий, осуществлялось по формуле R. Aaslid [18]: ICP = САД – (1,1 сАД х TAV В PSV –5), базирующейся на показателях периферической гемодинамики. Индекс гидродинамического сопротивления в системе вычисляли по формуле: RAP = САД В TAV. Полученный согласно равенству D. H. Evans [32] результат позволил детально изучить цереброваскулярную резистентность. С целью измерения величины вазодилататорного резерва, получения представления о состоянии динамической, миогенной ауторегуляции системы церебрального кровообращения и прогнозирования ее компенсаторных возможностей на основании каротидного компрессионного теста вычислялся коэффициент овершута (OF) [3]. OF = TAV2 В TAV1, где TAV1 — исходная усредненная по времени средняя скорость до компрессии ипсилатеральной общей сонной артерии (ОСА), TAV2 — TAV первого-второго пиков после прекращения компрессии ОСА.
Тяжесть отечного синдрома оценивалась по четырехбалльной шкале. Для измерения уровня протеинурии в однократной порции и в суточном количестве мочи использовался унифицированный метод Брандберга–Робертса–Стольникова.
Достоверность различий средних значений устанавливалась методом сравнения средних значений двух выборочных совокупностей с определением t-критерия Стьюдента и уровня значимости (p). Выборка однородная, распределение нормальное, подтверждено тестом Колмогорова–Смирнова. Равенство дисперсий в группах проверялось при помощи критерия Левена. Для определения меры зависимости между переменными применялась простая линейная корреляция (r) Пирсона. Необходимые вычисления были реализованы в прикладном пакете программ STATISTICA 6.0.
Первоначально мы определили показатели мозгового кровотока у беременных с гестозом различной степени тяжести (легкая, средняя, тяжелая), и установили достоверность различий средних значений в исследуемых подгруппах и группе сравнения (табл. 1–7). Анализируя данные, полученные при ТДГ средней мозговой артерии, мы выяснили, что у беременных из основной группы при прогрессировании гестоза наблюдается достоверное, симметричное с обеих сторон снижение всех линейных показателей допплеровского спектра. У всех беременных при прогрессировании гестоза нами отмечалось снижение линейной скорости кровотока, преимущественно за счет пиковой систолической скорости. Выявлено достоверное изменение уровня цереброваскулярного сопротивления на основании снижения индекса резистентности и пульсационного индекса в подгруппе пациенток с гестозом. Показатель систоло-диастолического отношения, отражающий состояние сосудистой стенки, увеличивался при нарастании тяжести гестоза. Было отмечено достоверное различие в ряде величин, отражающих уровень давления, гидродинамического сопротивления и цереброваскулярную реактивность в сравнении с аналогичными показателями у здоровых пациенток в 3-м триместре беременности. Прогрессирование гестоза у обследуемых пациенток привело к существенному повышению уровня гидродинамического сопротивления в системе. Уровень внутричерепного давления также значительно увеличился по мере прогрессирования гестоза. Напротив, показатель церебрального перфузионного давления, индекс мозгового кровотока и индекс стабильности потока оказались достоверно ниже в группе беременных с тяжелой формой гестоза.
После родоразрешения при динамическом наблюдении в течение вторых суток послеродового периода нами вновь были изучены показатели церебральной гемодинамики. В послеродовом периоде у рожениц нами отмечалось существенное, симметричное с обеих сторон увеличение всех определяемых нами линейных величин допплеровского спектра. Родоразрешение привело к существенному снижению уровня гидродинамического сопротивления в сосудах головного мозга у рожениц, страдающих гестозом. Понижение сосудистого сопротивления в артериях мозга, возможно, свидетельствует об аномалии регуляции тонуса интракраниальных сосудов и позволяет предположить нарушение сосудистой реактивности.
В послеродовом периоде было выявлено достоверное изменение уровня цереброваскулярного сопротивления на основании увеличения индекса резистентности и пульсационного индекса в группах пациенток с гестозом. Повышение линейной скорости кровотока в мозговых артериях, преимущественно за счет пиковой систолической скорости, вероятно, обусловлено снижением периферического сосудистого сопротивления, что указывает на особую значимость нарушения сосудистого тонуса в генезе расстройств мозговой гемодинамики при гестозе. Отмечено достоверное различие в ряде величин, отражающих уровень давления и цереброваскулярную реактивность в сравнении с аналогичными показателями у здоровых рожениц. Уровень внутричерепного давления значительно снизился. Напротив, показатель церебрального перфузионного давления, индекс мозгового кровотока и индекс стабильности потока оказались достоверно выше в подгруппе рожениц с тяжелым гестозом. На основании изменения коэффициента овершута в послеродовом периоде было отмечено понижение цереброваскулярной реактивности за счет вазодилататорного резерва по мере утяжеления гестоза.
На следующем этапе настоящего исследования проводился корреляционный анализ между параметрами мозгового кровотока и тяжестью гестоза, протеинурией, тяжестью отечного синдрома, показателями центральной и периферической гемодинамики (САД, КСО, КДО, УО, ФВ, ФУ, МОС, СИ, ОПСС). Прослеживается четкая обратная взаимосвязь между отдельными индикаторами мозгового кровообращения и тяжестью отечного синдрома, уровнями САД, протеинурии. Наиболее значимый коэффициент корреляции с отечным синдромом наблюдается в отношении пиковой систолической скорости (r = –0,71), конечной диастолической скорости (r = –0,66) и усредненной по времени средней скорости (r = –0,70) (табл. 1). Следовательно, при нарастании тяжести отечного синдрома снижается скорость мозгового кровотока. Между тем чем выше индекс гидродинамического сопротивления, указывающий на уровень сосудистого сопротивления, тем более выражен отечный синдром (r = 0,75).
Наиболее значимый коэффициент корреляции с уровнем протеинурии в разовой порции мочи по-прежнему наблюдается у пиковой систолической скорости (r = –0,61), конечной диастолической скорости (r = –0,50) и усредненной по времени средней скорости (r = –0,55) (табл. 2, 3). Следовательно, при нарастании уровня протеинурии снижается скорость мозгового кровотока. При увеличении индекса гидродинамического сопротивления возрастает потеря белка с мочой (r = 0,61). Подобной взаимосвязи должно уделяться особое внимание, так как прогностически наиболее неблагоприятными принято считать формы гестоза, сопровождающиеся глубоким нарушением функции почек и выраженной протеинурией.
Корреляционный анализ выявил отчетливую, но несущественную взаимосвязь между показателями мозгового кровотока и САД (табл. 4), что вполне закономерно, так как кровообращение в головном мозге имеет собственную систему ауторегуляции, блокирующую колебания АД.
Корреляционный анализ выявил тесную взаимосвязь мозгового кровотока и отдельных показателей центральной и периферической гемодинамики. Обнаружена отчетливая прямая корреляция скоростных параметров допплеровского спектра и объемных показателей центральной гемодинамики (табл. 5). Выявленная взаимосвязь подчеркивает значимость сердечного выброса для мозгового кровообращения и необходимость учета насосной функции сердца при оценке церебральной гемодинамики. Отмечается высокая обратная линейная зависимость между скоростными характеристиками допплеровского спектра и общим периферическим сопротивлением сосудов (табл. 6). Центральное повышение уровня гидродинамического сопротивления у пациенток, страдающих гестозом, подтверждает и отчетливая прямая корреляция индекса гидродинамического сопротивления церебральных сосудов и ОПСС (r = 0,86).
При изучении данных была выявлена отчетливая отрицательная линейная взаимосвязь между отдельными индикаторами церебральной гемодинамики и степенью тяжести гестоза (табл. 7). Наиболее высокий коэффициент корреляции наблюдается в отношении пиковой систолической скорости (r = –0,95), конечной диастолической скорости (r = –0,87) и усредненной по времени средней скорости (r = –0,90). Следовательно, с нарастанием тяжести гестоза наблюдается пропорциональное усугубление нарушений церебрального кровотока.
Наиболее значимый коэффициент корреляции отмечается при сравнении отдельных критериев тяжести гестоза с линейными скоростными параметрами допплеровского спектра и индексом гидродинамического сопротивления (PSV, EDV, TAV, ИГС). Таким образом, прогностически весьма существенными следует считать указанные выше показатели церебрального кровообращения.
Наблюдаемые изменения церебральной гемодинамики, выявленные в ходе исследования в группе пациенток с гестозом, весьма характерны для сосудистых сегментов, находящихся в состоянии вазодилатации. Вероятно, изменение тока крови указывает на пассивное расширение в области M1 сегмента средней мозговой артерии, которое может отмечаться в случае комбинации повышенного АД и сбоя в системе ауторегуляции. Становится очевидным, что мозговая ауторегуляция у беременных, страдающих гестозом, оказывается «несостоятельной», поскольку не соблюдается закономерность реакции мозговой гемодинамики, состоящая в повышении скорости кровотока по магистральным артериям мозга в ответ на увеличение САД. Между тем известно, что при достижении уровня АД, превышающего верхний предел ауторегуляции, возникает феномен sausage-string, заключающийся в сегментарной дилатации артериол, что, в свою очередь, сопряжено с опасностью прорыва крови в окружающую ткань мозга. Повышение показателя коэффициента овершута подтверждает предположение о предельно напряженном резерве вазодилатации. По нашему мнению, указанные процессы ведут к увеличению внутричерепного давления, развитию вазогенного отека и формированию гипертонической энцефалопатии, что прямо и косвенно подтверждается итогами настоящего наблюдения. Между тем пассивному расширению артериол сопутствует снижение церебрального перфузионного давления. На фоне очерченных патологических процессов формируется феномен Кохера–Кушинга, направленный на восстановление церебрального перфузионного давления, за которым, предположительно, должно последовать дальнейшее прогрессивное повышение САД, усугубление артериальной гипертензии и формирование порочного круга. В том случае, когда внутричерепная гипертензия превышает компенсаторные возможности системы кровообращения, уровень мозгового кровотока и объем кровенаполнения головного мозга резко снижаются, развивается гипоксия и ишемия головного мозга, тогда как ауторегуляция нарушается или полностью утрачивается. Таким образом, наблюдается патологическая перфузия головного мозга на фоне пассивного расширения артериол. Нарушение перфузии мозга следует считать симметричным, поскольку не было выявлено достоверных различий между аналогичными величинами, измеренными с обеих сторон. Из вышеуказанного можно сделать следующие выводы.
- При любой степени тяжести гестоза у беременных и рожениц отмечается нарушение перфузии мозга.
- Наличествует тесная взаимосвязь между мозговым кровообращением и отдельными критериями, определяющими тяжесть гестоза.
- Глубина расстройств мозгового кровообращения пропорциональна тяжести гестоза.
- Прогностически наиболее значимыми являются линейные показатели допплеровского спектра, а именно скоростные характеристики потока.
Внедрение метода ТДГ в акушерскую практику позволило не только детально изучить проблему нарушения мозгового кровообращения у здоровых и страдающих гестозом беременных и рожениц, но и установить ряд весьма существенных прогностических критериев тяжести этого опасного осложнения гестации. Результаты ТДГ помогают практикующим врачам своевременно и адекватно решать вопросы диагностики гестоза и оценки его тяжести. Показатели мозгового кровотока могут с успехом использоваться для установления степени эффективности терапевтических вмешательств и целесообразности пролонгирования беременности.
Литература
- Абрамченко В. В. Послеоперационная интенсивная терапия в акушерстве. СПб.: СпецЛит., 2000. 92 с.
- Айламазян Э. К. Неотложная помощь при экстремальных состояниях в акушерской практике. Н. Новгород, 1995. 281 с.
- Гайдар Б. В., Парфенов В. Е., Свистов Д. В. Оценка реактивности мозгового кровотока с применением ультразвуковых методов диагностики//Ультразвуковая допплеровская диагностика сосудистых заболеваний/под ред. Ю. М. Никитина, А. И. Труханова. М., 1998. № 9. С. 249–260.
- Зильбер А. П., Шифман Е. М. Акушерство глазами анестезиолога: Этюды критической медицины. Петрозаводск: Издательство ПГУ, 1997. Т. 3. 397 с.
- Кулаков В. И., Серов В. Н., Абубакирова А. М., Федорова Т. А. Интенсивная терапия в акушерстве и гинекологии (эфферентные методы). М.: Медицинское информационное агентство, 1998. 57 с.
- Кулаков В. И., Серов В. Н., Абубакирова А. М., Чернуха Е. А., Баранов И. И., Федорова Т. А. Анестезия и реанимация в акушерстве и гинекологии. М.: Триада — Х, 2000. С. 287–306.
- Мурашко Л. Е., Трусова Н. В. Гестоз у женщин с нарушением толерантности к глюкозе//Акушерство и гинекология. 1999. № 4. С. 19–22.
- Мурашко Л. Е., Юсопова Л. Н., Бурлеев В. А., Сокур Т. Н., Коноводова Е. Н. Объемный транспорт О2 у беременных с анемией и гестозом// Акушерство и гинекология. 1998. № 5. С. 18–22.
- Савельева Г. М. Патогенетическое обоснование терапии и профилактики гестозов//Вестник Российской ассоциации акушеров-гинекологов. 1998. № 2. С. 21–26.
- Савельева Г. М., Шалина Р. И. Современные проблемы этиологии, патогенеза, терапии и профилактики гестозов//Акушерство и гинекология. 1998. № 5. С. 6–9.
- Серов В. Н., Маркин С. А. Особенности инфузионной терапии в акушерской практике//Российский журнал анестезиологии и интенсивной терапии. 1999. № 2. С. 65–67.
- Серов В. Н., Стрижаков А. Н., Маркин С. А. Руководство по практическому акушерству. М.: ООО «Медицинское информационное агентство», 1997. 135 с.
- Шифман Е. М. Интенсивная терапия эклампсии: (Стандарт действий)// Актуальные проблемы медицины критических состояний. Петрозаводск: Издательство ПГУ, 1995. С. 106–108.
- Шифман Е. М. Преэклампсия — эклампсия: интенсивная терапия или профилактика?//Актуальные проблемы медицины критических состояний. Петрозаводск: Издательство ПГУ, 1994. С. 54–64.
- Шифман Е. М. Современные принципы и методы инфузионной терапии критических состояний в акушерстве//Актуальные проблемы медицины критических состояний. Петрозаводск, 1997. С. 30–54.
- Шифман Е. М., Тиканадзе А. Д., Вартанов В. Я. Инфузионно-трансфузионная терапия в акушерстве. Петрозаводск, 2001. 304 с.
- Шифман Е. М., Флока Е. И., Вартанов В. Я. Клиническая оценка лабораторых тестов у больных с гестозом//Медицинский курьер. 1991. № 3. С. 56–60.
- Aaslid R., Markwalder T. M. et al. Noninvasive transcranial Doppler ultrasound recording of flow velocity in basal cerebral arteries//J. Neurosurg. 1982; 57(6): 769–774.
- Belfort M. A., Giannina G., Herd J. A. Transcranial and orbital Doppler ultrasound in normal pregnancy and preeclampsia//Clin. Obstet. Gynecol. (United States). Sep 1999; 42 (3): 479–506.
- Belfort M. A., Grunewald C., Saade G. R. et al. Preeclampsia may cause both overperfusion and underperfusion of the brain: a cerebral perfusion based model// Acta Obstet Gynecol Scand (Denmark). Aug 1999; 78(7): 586–591.
- Belfort M. A., Saade G. R. et al. Change in estimated cerebral perfusion pressure after treatment with nimodipine or magnesium sulfate in patients with preeclampsia// Am. J. Obstet. Gynecol. (United States). Aug 1999: 81(2): 402–407.
- Belfort M. A., Saade G. R. et al. Nimodipine in the management of preeclampsia: Maternal and fetal effects//Am. J. Obstet. Gynecol. (United States). Aug 1994; 171(2): 417–424.
- Belfort M. A., Saade G. R., Grunewald C. et al. Association of cerebral perfusion pressure with headache in women with preeclampsia//Br. J. Obstet. Gynaecol. (England). Aug 1999; 106(8): 814–821.
- Belfort M. A., Saade G. R., Grunewald C. et al. Effects of blood pressure on orbital and middle cerebral artery resistances in healthy pregnant women and women with preeclampsia//Am. J. Obstet. Gynecol. (United States). Mar 1999; 180 (3 Pt 1): 601–607.
- Belfort M. A., Tooke-Miller C., Allen J. C. et al. Changes in flow velocity, resistance indices, and cerebral perfusion pressure in the maternal middle cerebral artery distribution during normal pregnancy//Acta. Obstet. Gynecol. Scand (Denmark). Feb 2001; 80(2): 104–112.
- Belfort M. A., Tooke-Miller C., Allen J. C. et al. Pregnant women with chronic hypertension and superimposed preeclampsia have high cerebral perfusion pressure// BJOG (England). Nov 2001; 108(11): 1141–1147.
- Belfort M. A., Tooke-Miller C., Varner M. et al. Evaluation of a noninvasive transcranial Doppler and blood pressure-based method for the assessment of cerebral perfusion pressure in pregnant women//Hypertens Pregnancy (United States). 2000; 19(3): 331–340.
- Belfort M. A., Varner M. W., Dizon-Townson D. S. et al. Cerebral perfusion pressure, and not cerebral blood flow, may be the critical determinant of intracranial injury in preeclampsia: a new hypothesis//Am. J. Obstet. Gynecol. (United States). Sep 2002; 187 (3): 626–634.
- Belfort M. A., Moise K. J. Jr. Effect of magnesium sulfate on maternal brain blood flow in preeclampsia: a randomized placebo-controlled study//Am. J. Obstet. Gynecol. 1992; 167(3): 661–666.
- Belfort M. A., Uys P. C., Dommise J. Haemodinamic changes in gestational proteinuric hyperteson: The effects of rapid volume expasion and vasodilator therapy//Br. J. Obstet. Gynaecol. 1989; 96: 634–641.
- Belfort M. A., Tooke-Miller C. The cerebral circulation in preeclampsia: abnormalities in autoregulation and perfusion//Acta. Obstet. Gynecol. Scand. (Denmark). Feb 2001. 81(2): 84–111.
- Evans D. H., Levene M. I. et al. Resistance index blood flow velocity and resistance area product in cerebral arteries of very low birth weight infants during the first week of life//Ultrasound. Med. Biol. 1988; 14(2): 103–110.
- Williams K. P. et al. Persistence of cerebral hemodynamic changes in patients with eclampsia: A report of three cases//Am. J. Obstet. Gynecol. 1999; 181(5 Pt 1): 1162–1165.
А. А. Ившин
Петрозаводский государственный университет, Петрозаводск
Приложения
-
- Мозговое кровообращение – зеркало гестоза? - Таблица 1
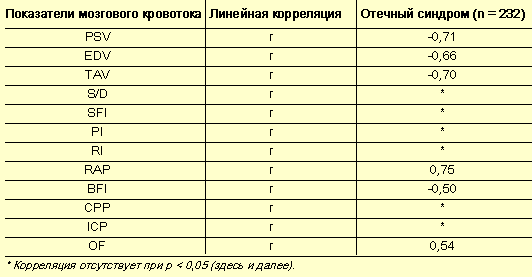
Корреляция мозгового кровотока и тяжести отечного синдрома
-
- Мозговое кровообращение – зеркало гестоза? - Таблица 2
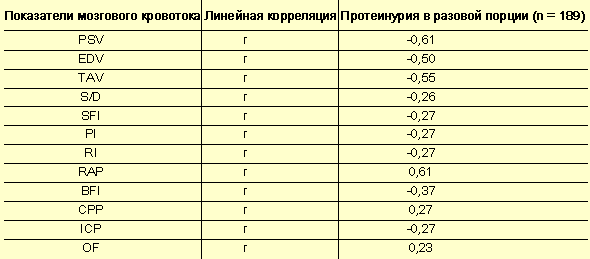
Корреляция мозгового кровотока и протеинурии в разовой порции
-
- Мозговое кровообращение – зеркало гестоза? - Таблица 3
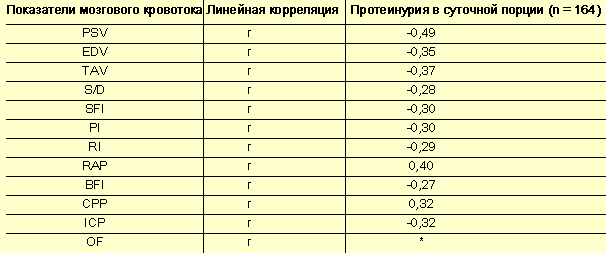
Корреляция мозгового кровотока и протеинурии в суточной порции
-
- Мозговое кровообращение – зеркало гестоза? - Таблица 4
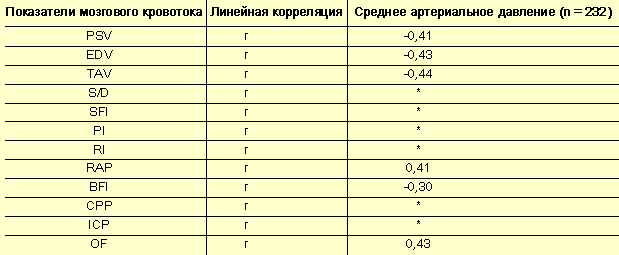
Корреляция мозгового кровотока и среднего артериального давления
-
- Мозговое кровообращение – зеркало гестоза? - Таблица 5
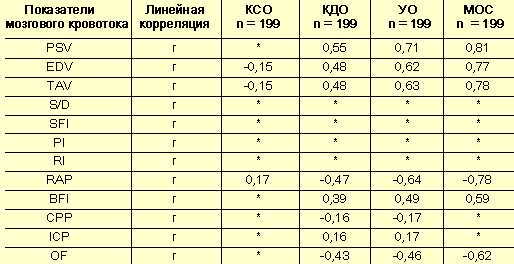
Корреляция мозгового кровотока и центральной гемодинамики
-
- Мозговое кровообращение – зеркало гестоза? - Таблица 6

Корреляция мозгового кровотока и периферической гемодинамики
-
- Мозговое кровообращение – зеркало гестоза? - Таблица 7
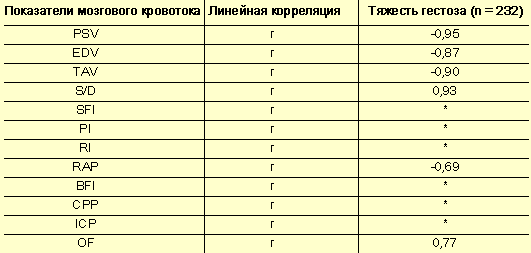
Корреляция мозгового кровотока и тяжести гестоза по шкале Goecke в модификации Г. М. Савельевой










