Cовременные контролируемые исследования и международные рекомендации
Острый коронарный синдром без стойкого подъема сегмента ST на электрокардиограмме (ЭКГ) является частью такого клинического симптомокомплекса, как острый коронарный синдром (ОКС), включающий большой спектр состояний, связанных с обострением ишемической болезни сердца (ИБС), от нестабильной стенокардии и инфаркта миокарда (ИМ) без подъема сегмента ST — ИМБПST (в Европе они объединены термином ОКСБПST), до ИМ с подъемом сегмента ST (ИМСПST) (рис).
Только около 25% среди госпитализируемых в Европе и США больных с ОКС составляют пациенты с острым ИМ с подъемом сегмента ST, а приблизительно 75% — больные с нестабильной стенокардией или ИМ без подъема сегмента ST [1].
Острый коронарный синдром без стойкого подъема сегмента ST является для клинициста важным диагнозом, так как при нестабильной стенокардии и ИМБПST лечебная тактика практически не различается и направлена на устранение ишемии миокарда, предупреждение и лечение осложнений. Важность выделения данного синдрома объясняется и тем, что при нем существенно возрастает риск смерти или нефатального ИМ, который наиболее выражен в течение первых 30 дней после появления симптомов [2].
Обсуждаются пять основных причин развития острого коронарного синдрома без подъема сегмента ST [3]:
- неокклюзирующий тромбоз в области атеросклеротической бляшки;
- динамическая обструкция коронарной артерии (спазм субэпикардиального участка коронарной артерии или констрикция мелких интрамуральных артерий);
- прогрессирующая механическая обструкция коронарной артерии;
- воспаление коронарной артерии;
- вторичная нестабильная стенокардия.
Как показывают данные ангиоскопических и ангиографических исследований, наиболее частой причиной развития данного заболевания является неокклюзирующий тромбоз на месте разрыва атеросклеротической бляшки.
Антитромбоцитарные средства (ацетилсалициловая кислота (АСК) и тиенопиридины). Лечение больных с ОКСБПST надо начинать (наряду с купированием болевого синдрома) с приема 160–325 мг (250 мг) АСК в таблетках, не покрытых кишечнорастворимой оболочкой, в сочетании с «нагрузочной» дозой (300 мг) клопидогреля (табл. 1). При использовании «нагрузочной» дозы клопидогреля в 300 мг эффективное ингибирование агрегации тромбоцитов достигается в течение от 4 до 6 ч, тогда как при назначении 75 мг препарата оно проявляется через 3–5 дней [4]. По некоторым данным, «нагрузочная» доза клопидогреля в 600 мг позволяет достичь этого эффекта в течение 2 ч [5]. Комбинацию этих препаратов Европейское общество кардиологов (ESC) рекомендует применять в течение 9–12 мес, а Американская коллегия кардиологов (АСС) и Американская ассоциация сердца (АНА) — до 9 мес [3], а затем используется одна АСК неопределенно долго (пожизненно или до появления побочных эффектов). После однократных «нагрузочных» доз АСК и клопидогреля в дальнейшем АСК назначается по 75–160 мг/сут, а клопидогрель — по 75 мг/сут. Кроме того, тиенопиридины — клопидогрель (в дозах, указанных выше) и тиклопидин (первая доза 500 мг, затем по 250 мг 2 раза в сутки, регулярный контроль за числом тромбоцитов и лейкоцитов) могут быть рекомендованы в случае непереносимости АСК: повышенная чувствительность или выраженное желудочно-кишечное расстройство. При этом надо отметить, что предпочтение отдается клопидогрелю, так как при применении этого препарата быстрее проявляется антитромботическое действие (особенно при применении «нагрузочной» дозы) и меньше побочных эффектов. Комбинация АСК и клопидогреля используется как у больных с низким риском (планируется только медикаментозное лечение), так и перед проведением коронарной ангиопластики и после нее. Для уменьшения риска возникновения кровотечений целесообразно отменить клопидогрель по крайней мере за 5 (лучше за 7) дней до выполнения операции коронарного шунтирования.
Поэтому если в первые 24–36 ч после госпитализации планируется коронароангиография, то клопидогрель не назначается до тех пор, пока не решится вопрос о целесообразности и сроках проведения КШ. В том случае, когда после коронароангиографии будет принято решение о немедленном выполнении чрескожных коронарных вмешательств (ЧКВ) (баллонная ангиопластика или стентирование коронарной артерии), «нагрузочная» доза препарата может быть дана прямо на катетеризационном столе.
Не следует применять в качестве антиагрегантов дипиридамол, сульфинпиразон (противоподагрическое средство, в больших дозах нарушающее агрегацию тромбоцитов), простациклин и его аналоги, потому что они не влияют на течение и/или прогноз ОКСБПST [3]. Говоря об антитромбоцитарных препаратах, следует отметить отсутствие данных о пользе пероральных ингибиторов тромбоцитарных гликопротеиновых рецепторов IIb/IIIa (ИГПР IIb/IIIa) у больных с ОКС без подъема сегмента ST. Не имеют преимущества перед АСК блокаторы тромбоксансинтетазы и антагонисты рецепторов тромбоксана А2 [3].
Антитромбоцитарное действие АСК связано с ингибированием циклооксигеназы-1 и в связи с этим со снижением синтеза тромбоксана А2 (ТхА2), что нарушает один из путей агрегации тромбоцитов. Максимальное уменьшение агрегации тромбоцитов достигается при уменьшении образования ТхА2 не менее чем на 90%. АСК эффективна у больных с высоким риском сердечно-сосудистых осложнений, включая нестабильную стенокардию, ИМ, хроническую стабильную стенокардию, ишемический инсульт, тогда как у лиц с низким риском их развития (здоровые индивидуумы без факторов риска сердечно-сосудистых заболеваний) ее профилактический эффект минимален. Хотя исследований по сравнению эффективности различных доз АСК у больных с ОКС без подъема сегмента ST не проводилось, представляется, что ее дозы, превышающие 80–160 мг/сут, не обладают большей эффективностью, но увеличивают риск развития кровотечений. Однако начинать лечение (первый прием) для быстрого наступления эффекта, если больной до этого не получал АСК, надо с 160–325 мг препарата (разжевать таблетку перед проглатыванием). У больных, которым уже назначали АСК, курс лечения следует продолжить.
АСК противопоказана при повышенной чувствительности к салицилатам, включая случаи бронхиальной астмы, у больных с активным кровотечением, гемофилией, кровоизлияниями в сетчатку, а также в случаях наличия потенциальных источников кровотечения (желудочно-кишечный тракт, мочеполовая система) и при тяжелой неконтролируемой артериальной гипертензии. В исследованиях по первичной профилактике сердечно-сосудистых заболеваний ее использование было связано с небольшим увеличением частоты возникновения внутричерепных кровоизлияний.
При длительном совместном применении АСК и ингибиторов ангиотензинпревращающего фермента (иАПФ), особенно у больных с тяжелой застойной хронической сердечной недостаточностью (ХСН), возможно некоторое ослабление гемодинамических эффектов иАПФ. В большинстве случаев это существенно не влияет на их клиническую эффективность. В то же время надо иметь в виду, что в этих ситуациях альтернативой иАПФ могут служить антагонисты рецепторов ангиотензина II, а АСК — клопидогрель. При назначении АСК больным с ХСН ее доза должна составлять не более 100 мг в сутки [7].
Клопидогрель и тиклопидин, относящиеся к тиенопиридиновым антиагрегантам, способны селективно угнетать АДФ-индуцированную агрегацию тромбоцитов. В отличие от АСК они не влияют на активность циклооксигеназы, продукцию тромбоксана тромбоцитами и простациклина клетками эндотелия. При приеме внутрь тиенопиридины трансформируются в печени в активные метаболиты, которые и обладают антитромбоцитарным эффектом. Их антиагрегантное действие необратимо, но при назначении «обычных» доз оно проявляется позже, чем у АСК (только через несколько дней). После отмены тиенопиридинов функция тромбоцитов восстанавливается медленно.
Тиенопиридины можно применять для вторичной профилактики ИМ, ишемического инсульта, лечения ОКСБПST, а также с целью предупреждения окклюзии коронарных стентов и шунтов. Исследование CAPRIE (Clopidogrel versus aspirin in patients at risk of a ischaemic events), в которое были включены 19 185 больных с ИМ, инсультом, стенозирующим атеросклерозом периферических артерий, получавших АСК в дозе 325 мг/сут или клопидогрель — 75 мг/сут, показало, что клопидогрель не менее эффективен, чем АСК, а вероятно, даже превосходит его в профилактике сердечно-сосудистых осложнений. Относительный риск развития ИМ, инсульта, внезапной сердечной смерти был меньше на 8,7% (p = 0,043) при использовании клопидогреля [8].
Таким образом, клопидогрель является наиболее совершенным препаратом этой группы. Этот высокоэффективный антиагрегант значительно быстрее тиклопидина проявляет антиагрегантное действие и имеет меньше побочных эффектов. Так, в ходе исследования CLASSICS [9], включавшего 1020 больных, которым проводилось стентирование коронарной артерии, была установлена большая безопасность клопидогреля по сравнению с тиклопидином. Осложнения (кровотечения, тромбоцитопения и нейтропения, другие побочные эффекты) практически в 2 раза чаще регистрировались у больных, получавших тиклопидин (9,12% по сравнению с 4,56%). По данным литературы, у 10–15% больных, получающих тиклопидин в рекомендованных дозах (по 250 мг 2 раза в сутки), развиваются побочные эффекты. Наиболее серьезными из них являются нейтропения, тромбоцитопения, агранулоцитоз, тромбоцитопеническая пурпура. Поэтому в течение первых 3 мес лечения тиклопидином рекомендуется каждые 2 нед делать анализ крови.
Необходимость совместного применения клопидогреля и АСК при ОКСБПST была доказана в ходе рандомизированного, двойного слепого, плацебо-контролируемого исследования CURE (Clopidogrel in unstable angina to prevent recurrent events) [10], в которое было включено 12 562 больных (средний возраст 64 года) из 482 медицинских центров, расположенных в 26 странах. Не позднее чем через 24 ч после появления симптомов они были разделены на две группы (6259 больных), получавших клопидогрель (сначала 300 мг, затем 75 мг 1 раз в сутки), и группу (6303 больных), получавших плацебо. Клопидогрель и плацебо в обеих группах назначались в дополнение к АСК (от 75 до 325 мг/сут). Средняя продолжительность наблюдения за больными составляла 9 мес (от 3 до 12 мес).
Внезапная сердечная смерть, нефатальный ИМ или инсульт достоверно реже регистрировались у больных, принимавших клопидогрель с АСК: у 582 из 6259 больных (9,3%) группы, получавшей клопидогрель, по сравнению с 719 из 6303 больных (11,4%) группы плацебо (относительный риск в группе применения клопидогреля по сравнению с группой плацебо — 0,8, 95% ДИ от 0,72 до 0,90; р < 0,001). Важно отметить, что это преимущество было отмечено уже в первые 24 ч лечения. Количество больных, у которых во время госпитализации рецидивировал тяжелый болевой синдром, развилась сердечная недостаточность или потребовалась реваскуляризация миокарда, также было меньше в группе, получавшей клопидогрель. Однако серьезных кровотечений было больше при совместном использовании клопидогреля и АСК, чем АСК и плацебо (3,7% по сравнению с 2,7%, относительный риск — 1,38; р = 0,001). Количество угрожающих жизни кровотечений (включая геморрагический инсульт) существенно не различалось в обеих группах (2,1% и 1,8%; р = 0,13).
Анализ исследования PCI-CURE [11], в ходе которого 2658 больным было выполнено баллонирование или стентирование коронарной артерии (наблюдение до 1 года после ЧКВ), указывает на то, что положительное значение комбинации клопидогреля с АСК имеет место не только при фармакотерапии ОКСБПST, но и при инвазивных методах лечения (достоверное снижение сердечно-сосудистых осложнений). Подобные данные получены в результате исследования CREDO (2116 больных, подвергшихся ЧКВ, 2/3 из которых были с ОКС) [12]. Продолжительное применение клопидогреля и АСК (в течение 1 года) привело к сокращению на 26,9% (р = 0,02) случаев смерти, ИМ и инсульта по сравнению с группой, получавшей АСК и плацебо. В этом исследовании также отмечено, что эффективность лечения была выше, когда нагрузочная доза клопидогреля (300 мг) и АСК (325 мг) назначались не менее чем за 6 ч до проведения коронарной ангиопластики.
ИГПР IIb/IIIa. Относительно новым видом антиагрегантов являются ИГПР IIb/IIIa, которые блокируют конечный этап агрегации тромбоцитов — связывание фибриногена и/или фактора фон Виллебранда с ГПРIIb/IIIa. Они существенно отличаются друг от друга по своей фармакокинетике и фармакодинамике. Некоторые данные об основных вводимых внутривенно препаратах этого класса представлены в таблице 2.
Метаанализ шести больших рандомизированных исследований, включавших 31 402 больных с ОКСБПST, показал, что внутривенное введение ИГПРIIb/IIIa приводит к небольшому снижению абсолютного риска смерти или ИМ в течение 30 дней: на 1% по сравнению с контрольной группой (10,8% и 11,8% соответственно; р = 0,015) [14]. В основном существенное улучшение отмечалось у больных, подвергшихся коронарной ангиопластике. Не было достоверного эффекта у больных без ЧКВ и при отсутствии увеличения уровня тропонинов в плазме крови (группа низкого риска).
Таким образом, внутривенное введение ИГПРIIb/IIIa (при продолжении применения АСК и гепарина), безусловно, показано в случаях проведения ангиопластики (АСС/АНА guidelines, 2002; ESC guidelines, 2002), так как все исследования с использованием абциксимаба, тирофибана и эптифибатида у этой категории больных с ОКС без подъема сегмента ST указывали на улучшение исходов заболевания по сравнению с плацебо (EPIC, EPILOG, CAPTURE, IMPACT II, RESTORE, EPISTENT). Эффективность ИГПРIIb/IIIa при медикаментозном лечении (без ЧКВ) в группе высокого риска (повышение уровня сердечных тропонинов Т или I, рецидивирующая ишемия миокарда, сахарный диабет и др.) менее очевидна, но применение их вполне допустимо (АСС/АНА guidelines, 2002: класс IIa, уровень доказательства А). Однако больным, которым не планируется ЧКВ, рекомендуются только тирофибан и эптифибатид, но не абциксимаб, терапия которым даже в группе высокого риска оказалась неэффективной, а иногда приводила к ухудшению прогноза [15]. Не имеет смысла назначать этот вид антиагрегантов больным ОКСБПST с низким риском осложнений.
ИГПРIIb/IIIa должны обязательно применяться совместно с гепарином (в большинстве ранних исследований использовался нефракционированный гепарин (НФГ), но к настоящему времени есть данные об успешном их сочетании с гепарином с низким молекулярным весом (ГНМВ), так как при лечении только ИГПРIIb/IIIa количество плохих исходов заболевания больше, чем при комбинированной терапии [2, 16]. Доказательства успешного и безопасного применения эптифибатида с эноксапарином натрия получены, в частности, в ходе исследования INTERACT: количество кровотечений оказалось даже меньше при назначении эптифибатида с эноксапарином натрия, чем с НФГ [17].
При лечении ИГПРIIb/IIIa возрастает риск кровотечений, которые чаще всего регистрируются в месте пункции сосуда во время коронарной ангиопластики. Количество больших кровотечений, по разным данным, колеблется от 0,4 (без инвазивных вмешательств) до 3% и более (у больных с ЧКВ и коронарным шунтированием). В то же время нет данных об увеличении числа внутричерепных кровоизлияний при добавлении к стандартной терапии ИГПРIIb/IIIa. У 2–3% больных ИГПРIIb/IIIa вызывают тромбоцитопению (менее 100 000 в 1 мм3). Тяжелая тромбоцитопения (менее 50 000 в 1 мм3) встречается редко — в 0,5% случаев. Прекращение лечения обычно сопровождается нормализацией количества тромбоцитов.
Антикоагулянты. Большое значение в ведении больных с ОКСБПST придается антикоагулянтам, которые оказывают существенное влияние на уменьшение прогрессирования патологического процесса и развитие осложнений. Имеются убедительные доказательства того, что эффективность НФГ у данных больных выше, чем при использовании плацебо. В то же время анализ результатов нескольких исследований по комбинированному лечению НФГ и АСК не показал его значимого преимущества по сравнению с применением только АСК [18]. Тем не менее четко прослеживается тенденция к уменьшению риска смерти и развития ИМ при ОКСБПST (на 33–56% в течение 5 дней — 12 нед) в результате совместного использования НФГ и АСК [19, 20]. Поэтому эта комбинация до сих пор рекомендуется ESC [18] и АСС/АНА [3], в качестве стандартной терапии ОКС без подъема сегмента ST (см. табл. 1).
Продолжительность лечения НФГ составляет 2–5 дней. Недостатком НФГ является непредсказуемость его антикоагулянтного действия при внутривенном введении одной и той же дозы препарата разным больным. В связи с этим необходимо осуществлять регулярный (каждые 6 ч) контроль за активированным частичным тромбиновым временем (АЧТВ), целевой уровень которого должен в 1,5–2,5 раза превышать норму (достигать приблизительно 50–70 с). Кроме того, определять АЧТВ следует через 4–6 ч после каждого изменения скорости введения препарата и при ухудшении состояния больного (рецидив болей, кровотечение, артериальная гипотензия и др.). Если дважды значения АЧТВ будут соответствовать целевому уровню, его можно контролировать через каждые 24 ч. Номограмма для коррекции скорости внутривенного введения НФГ представлена в таблице 3.
Многие годы НФГ (наряду с оральными антикоагулянтами) был основным препаратом для лечения и профилактики тромботических осложнений при различных сердечно-сосудистых заболеваниях. Однако, несмотря на высокую эффективность, НФГ имеет ряд недостатков и серьезных побочных эффектов, которые в определенной степени удалось преодолеть после создания ГНМВ.
ГНМВ получают путем различных способов (химических и ферментативных) деполимеризации НФГ, в результате чего образуются его фрагменты с более низким молекулярным весом (от 4000 до 6500 дальтон). Данные нарушения структуры гепарина приводят к изменениям в его фармакодинамике и фармакокинетике.
В отличие от НФГ, ГНМВ обладают большей активностью в ингибировании Ха-фактора свертывания и меньше влияют на IIa-фактор (тромбин). Отношение анти-Ха к анти-IIa-активности различных ГНМВ варьирует от 2:1 до 4:1 [21].
ГНМВ обладают значительно большей биодоступностью при подкожном введении, чем НФГ (соответственно 90% и 30%). К преимуществу первых перед НФГ относится также существенно большая продолжительность периода полувыведения. Все это дает им возможность вызывать устойчивую и предсказуемую гипокоагуляцию при одно- или двухразовом подкожном введении. Кроме того, применение ГНМВ в большинстве случаев не требует лабораторного мониторинга. Анализ большого клинического материала показывает, что тяжелые и фатальные кровотечения реже регистрируются при подкожном введении ГНМВ, чем при внутривенном применении НФГ [21].
Проведено более 10 рандомизированных исследований, посвященных сравнению воздействия ГНМВ и плацебо, АСК или НФГ у больных ОКСБПST. Было установлено, что эффективность ГНМВ выше, чем при приеме плацебо, а их сочетание с АСК более эффективно, чем монотерапия АСК [1]. Однако при сопоставлении различных ГНМВ (эноксапарин натрия, далтепарин натрия, надропарин кальция) с НФГ, выполненном в четырех крупных исследованиях, были получены неоднородные результаты.
Не наблюдалось различий в исходах заболевания при приеме далтепарина натрия и НФГ (исследование FRIC — 1482 больных с ОКСБПST) [22], а при сравнении надропарина с НФГ (исследование FRAXIS — 3468 больных с ОКСБПST) [23] была выявлена даже тенденция к ухудшению прогноза в группе надропарина кальция. С другой стороны, при метаанализе результатов двух исследований с эноксапарином натрия (TIMI11B — 3910 больных с ОКСБПST и ESSENCE — 3171 больной с ОКСБПST) было установлено, что при его применении происходит статистически значимое уменьшение частоты смерти, ИМ и экстренной реваскуляризации миокарда на 20% по сравнению с больными, получавшими НФГ (наблюдение 43 дня) [24]. При этом, в данных исследованиях эноксапарин натрия был наиболее эффективен у больных средней и высокой группы риска (более 3 баллов по шкале риска TIMI). Лечение эноксапарином натрия не ассоциировалось с увеличением количества тяжелых кровотечений (1,3% и 1,1% соответственно; р = 0,35), но приводило к определенному росту числа небольших кровотечений (10,0% и 4,3% соответственно; р < 0,0001). Применение эноксапарина натрия показало несколько большую эффективность и безопасность, чем применение НФГ в тех исследованиях, где использовались ИГПР IIb/IIIa.
В 2005 г. были опубликованы результаты исследования EVET [23], в ходе которого проводилось прямое сравнение эффективности двух ГНМВ — эноксапарина натрия и тинзапарина (438 больных с ОКСБПST, наблюдение в течение 6 мес). Через 6 мес комбинированная тройная конечная точка (смерть, ИМ, рецидивирующая ишемия миокарда) была меньше у больных, получавших эноксапарин натрия (25,5% по сравнению с 44%; р < 0,01). Случаев смерти и ИМ также было меньше за этот период времени в группе применения эноксапарина натрия (2,7% по сравнению с 6,9%; р = 0,046). На основании вышеизложенного можно сделать вывод, что в настоящее время эноксапарин натрия является препаратом выбора у больных с ОКСБПST.
ГНМС надо отменять по крайней мере за 24 ч до проведения КШ, а во время операции использовать НФГ. Они назначаются на 2–8 сут (одновременно с приемом АСК и клопидогреля) в тех дозах, которые использовались в цитируемых нами исследованиях (см. табл. 1). Пока нет достаточных доказательств того, что продолжительное использование ГНМВ у всех больных с ОКС без подъема сегмента ST приводит к увеличению эффективности лечения. В то же время, учитывая результаты исследования FRISCII [26], можно предположить, что более длительное назначение ГНМВ (по крайней мере до 2 нед) целесообразно у больных высокой группы риска, которым проводится только консервативное лечение, а также в случаях задержки реваскуляризации миокарда (в исследовании FRISCII улучшение прогноза заболевания у этих больных отмечалось при введении ГНМВ — далтепарина натрия в течение 30–90 дней).
Интенсивному изучению подвергаются прямые ингибиторы тромбина (гирудин, бивалирудин, лепирудин и др.), которые непосредственно связываются с фактором IIa и эффективно препятствуют тромбообразованию. Несмотря на то, что в ряде работ выявлено улучшение прогноза при использовании этих прямых ингибиторов тромбина, метаанализ исследований с их применением не показал существенного преимущества данной группы препаратов над НФГ в снижении риска ИМ и смерти от сердечно-сосудистых заболеваний у больных ОКСБПST [1]. Поэтому их использование одобрено только при гепарининдуцированной тромбоцитопении.
Пока что нет достаточных оснований и для того, чтобы рекомендовать широкое применение при ОКСБПST единственного орального прямого ингибитора тромбина ксимелагатрана, длительное использование которого к тому же сопровождается у 6–10% больных существенным увеличением уровня печеночных ферментов.
Первым представителем нового класса антитромботических препаратов, селективно ингибирующих фактор Ха, является синтетический пентасахарид фондопаринукс. Период полувыведения его составляет от 17 до 21 ч. Однократное подкожное введение фондопаринукса не требует контроля за показателями гемостаза. Доказано, что он высоко эффективен в профилактике тромбоза глубоких вен и тромбоэмболии легочной артерии после ортопедических операций, а также у больных нехирургического профиля [21]. Обнадеживающие данные по улучшению прогноза у больных с ОКСБПST при применении фондопаринукса (по сравнению с эноксапарином натрия) были получены в ходе исследования Pentua и при оценке предварительных результатов исследования OASIS-5. Однако для точной оценки его клинической значимости в лечении ОКС без подъема сегмента ST, вероятно, необходимы более веские доказательства.
Несмотря на то, что тромбоз коронарной артерии играет важную роль в патогенезе ОКСБПST, несколько хорошо контролируемых исследований не показали улучшения выживаемости и/или уменьшения сердечно-сосудистых осложнений у больных с данным синдромом при применении тромболитиков [27, 28, 29]. Поэтому тромболитическая терапия не рекомендуется для лечения нестабильной стенокардии и ИМ без подъема сегмента ST [3, 18].
Литература
- Cannon C. P., Braunwald E. Unstable angina and non-ST elevation myocardial infarction. In Braunwald E., Zipes L., Libby P., Bonow R. (eds.)//Heart disease. Saunders company. 2005; 1243–1279.
- PURSUIT trial investigators. Inhibition of platelet glycoprotein IIb/IIIa with eptifibatide in patients with acute coronary syndromes//N. Engl. J. Med. 1998; 339: 436–443.
- ACC/AHA guidelines for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction//J. Am. Coll. Cardiol. 2002; 40: 1366–1374.
- Helft G., Osende J. I., Worthley S. G. et al. Acute antithrombotic effect of a front-loaded regimen of clopidogrel in patients with atherosclerosis on aspirin//Arterioscler. Thromb. Vasc. Biol. 2000; 20: 2316–2320.
- Muller I., Seyfarth M., Rudiger S. et al. Effect of high loading dose of clopidogrel on platelet function in patients undergoing coronary stent placement//Heart. 2001; 85: 92–97.
- Management of acute myocardial infarction in patients presenting with ST-segment elevation. The task force on the management of acute infarction of the European society of cardiology//Eur. Heart J. 2003; 24: 28–66.
- Becker R. C., Fintel D. S., Green D. Antithrombotic therapy. Third edition//Professional communications. 2004; 79–97.
- CAPRIE steering committe. A randomized, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE)//Lancet. 1996; 348: 1329–1339.
- Bertrand M. E. Double-blind study of the safety of clopidogrel with and without a loading dose in combination with aspirin compared with ticlopidine in combination with aspirin after coronary stenting (CLASSICS)//Circulation. 2001; 102: 624–629.
- Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation//N. Engl. J. Med. 2001; 345: 494–502.
- Mehta S. R., Yusuf S., Peters R. J. et al. Effects of pretreatment with clopidogrel and aspirin followed by long-term therapy in patients undergoing percutaneous coronary intervention: the PCI-CURE study//Lancet. 2001; 358: 527–533.
- Steinhubl S. R., Berger P. B., Mann J. T. et al. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention. A randomized controlled trial//JAMA. 2002; 288: 2411–2420.
- Becker R. C., Fintel D. S., Green D. Antithrombotic therapy. Third edition//Professional communications. 2004; 201–235.
- Boersma E., Harrington R. A., Moliterno D. J. et al. Platelet glycoprotein IIb/IIIa inhibitors in acute coronаry syndromes: a metaanalysis of all major randomised clinical trials//Lancet 2002; 359: 189–198.
- Simoons M. L. Effect of glycoprotein IIb/IIIa receptor blocker abciximab on outcome in patients with acute coronary syndromes without early coronary revascularisation: the GUSTO IV-ACS randomized trial//Lancet. 2001; 357: 1915–1924.
- Platelet receptor inhibition in ischemic syndrome management in patients limited by unstable sings and symptoms (PRISM-PLUS) study investigators//N. Engl. J. Med. 1998; 338: 1488–1497.
- Goodman S. G., Fitchet D., Armstrong P. W. et al. Integrilin and enoxaparin randomized assessment of acute coronary syndrome treatment (INTERACT) trial investigators//Circulation. 2003; 107: 238–244.
- Management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. The task forse on management of acute coronary syndromes of the European society of cardiology//Eur. Heart. J. 2002; 23: 1809–1840.
- Cohen M., Adams P. C., Parry G. et al. Combination antithrombotic therapy in unstable rest angina and non-Q-wave infarction in nonprior aspirin users: primary and points analysis from the ATACS trial//Circulation. 1994; 89: 81–88.
- Oler A., Whooley M. A. Oler J., Grady D. Adding heparin to aspirin reduces the incidence of myocardial infarction and death in patients with unstable angina meta-analysis//JAMA. 1996; 276: 811–815.
- Becker R. C., Fintel D. J., Green D. Antithrombotic therapy. Third edition//Professional communications. 2004; 36–57.
- Klein W., Buchwald A., Hillis S. E. et al. Comparison of low-molecular-weight heparin with unfractionated heparin acutely and with placebo for 6 weeks in the management of unstable coronary artery disease. FRIC study//Circulation. 1997; 96: 61–68.
- FRAXIS study group. Comparison of two treatment durations (6 days and 14 days) of a low molecular weight heparin with 6-day treatment of unfractionated heparin in the initial management of unstable angina or non-Q wave myocardial infarction//Eur. Heart. J. 1999; 20: 1553–1562.
- Antman E. M., Cohen M., Radley D. et al. Assessment of the treatment effect of enoxaparin for unstable angina/non-Q-wave myocardial infarction. TIMI 11B — ESSENCE meta-analysis// Circulation. 1999; 100: 1602–1608.
- Kastouras C., Michalis L. K., Papamichael N. Enoxaparin versus tinzaparin in non-ST-segment elevation acute coronary syndromes: results of the enoxaparin versus tinzaparin (EVET) trial at 6 months//Av. Heart. J. 2005; 150: 385–391.
- Fragmin and fast revascularization during instability in coronary artery disease investigators: FRISCII prospective randomized multicentre study//Lancet. 1999; 354: 701–707.
- Effects of tissue plasminogen activator and a comparison of early invasive and conservative strategies in unstable angina and non-Q-wave myocardial infarction (TIMI IIIB trial)//Circulation. 1994; 89: 1545–1556.
- Baigent C., Collins R., Appleby P. et al. ISIS — 2:10 year survival among patients with suspected acute myocardial infarction in randomized comparison of intravenous streptokinase, oral aspirin, both, or neither//BMJ. 1998; 316: 1337–1343.
- Schreiber T. L., Rizik D., White C. et al. Randomised trial of thrombolysis versus heparin in unstable angina//Circulation. 1992; 86: 1407–1414.
Ю. А. Бунин, доктор медицинских наук, профессор
РМАПО, Москва
Приложения
-
- Антитромботическая терапия острого коронарного синдрома без стойкого подъема сегмента ST - Рисунок.
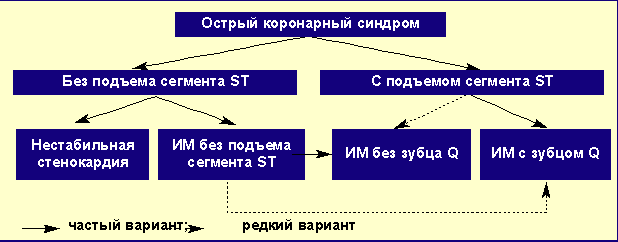
Варианты острого коронарного синдрома
-
- Антитромботическая терапия острого коронарного синдрома без стойкого подъема сегмента ST - Таблица 1

Клиническое использование антитромботических препаратов при лечении ОКСБПST *
-
- Антитромботическая терапия острого коронарного синдрома без стойкого подъема сегмента ST - Таблица 2

Характеристика ИГПР IIb/IIIa*
-
- Антитромботическая терапия острого коронарного синдрома без стойкого подъема сегмента ST - Таблица 3

Номограмма внутривенного введения НФГ с использованием относительных величин изменений АЧТВ *









