
В последние годы вопросам стандартной диетотерапии фенилкетонурии уделялось достаточное внимание. На протяжении последних 15 лет отрабатывались протоколы питания детей с фенилкетонурией. Однако при этом проблему диетотерапии фенилкетонурии в стрессовых нестабильных ситуациях обходили стороной.
Часто в практике врача-генетика встречаются случаи, когда у пациента на фоне какого-либо соматического заболевания, инфекции, потери аппетита и т. д. увеличивается уровень фенилаланина в крови. Является ли это результатом неправильного питания? Попробуем разобраться в этой проблеме. Для этого нам необходимо вспомнить основы метаболизма.
Причинами повышения уровня фенилаланина при фенилкетонурии являются:
- повышенное либо недостаточное поступление натурального белка с пищей;
- метаболический стресс: энергетические потери - катаболизм белков;
- инфекции;
- соматические заболевания;
- физическая активность;
- потеря аппетита.
Фактически все эти ситуации (кроме повышенного поступления в организм белка натуральных продуктов) сводятся к недостатку белка лечебной смеси в результате повышения потребностей организма в энергии и нутриентах, их недостаточному поступлению или, проще говоря, к «скрытому голоданию». В качестве примера в таблице 1 приведены резервные показатели субстратов для организма ребенка весом 32 кг.
В короткие периоды «голодания» происходит снижение уровня инсулина и повышение секреции глюкагона и катехоламина, приводящее к гликогенолизу и липолизу. Гидролиз триглицеридов в жировой ткани освобождает свободные жирные кислоты и глицерин в кровоток, где они транспортируются к таким органам, как скелетная и сердечная мышцы, почки и печень (источник кетонов), и используются в качестве топлива. Потребности мозга и эритроцитов в глюкозе первоначально удовлетворяются за счет гликогенолиза (24 ч), а позже — за счет глюконеогенеза.
В случае «голодания», продолжающегося более 72 ч, уровень инсулина по-прежнему снижается. Отмечается также и уменьшение запасов гликогена, при этом необходимая глюкоза образуется в основном в процессе глюконеогенеза. В связи с тем, что жирные кислоты не могут превращаться в глюкозу, протекание этого процесса в печени и почках зависит от поступления необходимых для него субстратов: аминокислот из мышц, глицерина из жировой ткани и лактата, получающегося за счет анаэробного гликолиза в мышечной ткани (цикл Кори). В процессе глюконеогенеза углеродный скелет аминокислот вступает на путь глюконеогенеза, а аминогруппы превращаются в мочевину и ежедневно выделяются, приводя к отрицательному азотистому балансу и потере до 75 г белка (300 г мышечной ткани). Сохранение белкового пула может осуществляться двумя способами: путем снижения интенсивности обмена веществ на 10–15% и путем снижения потребления глюкозы, так как мозг (который потребляет 20% общих энергетических затрат) приспосабливается к использованию кетоновых тел в качестве источника энергии.
Итак, простое голодание вызывает снижение массы тела, преимущественно за счет потери жира, а также уменьшение тощей массы тела, приводя к истощению организма, что в целом можно охарактеризовать как нарушение питания по типу маразма. У пациентов с недостаточностью питания по типу маразма отмечается снижение потребления энергии и белка.
Голодание при стрессе, так называемый квашиоркор, или недостаточность питания в виде гипоальбуминемии, развивается как ответ на сочетание голодания и воспаления. Раньше предполагалось, что квашиоркор является результатом низкого потребления белка. Однако при тяжелом и остром воспалении квашиоркор может развиться в течение нескольких дней. У пациентов, страдающих хроническими воспалительными заболеваниями, истощение развивается постепенно в течение нескольких недель или месяцев. Воспалительную реакцию контролируют гормоны и цитокины.
В настоящее время бытует мнение, что нарушение питания по типу квашиоркора индуцируется при наличии воспалительного процесса у ребенка, у которого в большинстве случаев уже было нарушение питания по типу маразма.
В результате реакции на воспаление отмечается повышенный уровень адреналина, глюкагона и кортизола. Эти катаболические гормоны приводят к липолизу, глюконеогенезу и усиленному катаболизму белка.
Стрессовые гормоны вызывают инсулинорезистентность, в результате чего развиваются гипергликемия, гиперинсулинемия, а также повышается выработка глюкозы печенью. В ответ на воспаление синтезируются такие цитокины, как интерлейкин-1 и фактор некроза опухолей. Эти цитокины оказывают значительные катаболические эффекты на белки организма. Воспалительная реакция при стрессе приводит к росту расхода энергии и прогрессирующей потере клеточной массы тела. Гликоген расходуется достаточно быстро. Незначительное количество белка окисляется напрямую, однако он служит главным образом источником незаменимых субстратов.
Субстраты, высвобождающиеся из мышечной, жировой ткани, костей и других органов, повторно утилизируются. Эти субстраты необходимы для синтеза различных медиаторов белковой и липидной природы, а также антиоксидантов. Аминокислоты, образующиеся в результате распада белков организма (главным образом мышечных белков), используются для синтеза острофазовых белков и факторов свертывания для глюконеогенеза и для процессов репарации. Глютамин и другие аминокислоты являются субстратами для иммунной системы, слизистой кишечника и процессов регенерации. В то же время утилизируемые белки организма являются также дополнительным источником фенилаланина, приводя к увеличению его уровня в крови.
Парадокс метаболического ответа на стресс состоит в том, что, являясь важнейшей приспособительной реакцией, направленной на обеспечение организма необходимыми субстратами, стресс в экстремальных случаях может приводить к нарушению функций организма и потере массы, а при фенилкетонурии — к ухудшению течения заболевания.
Синтез и обмен белка
Открытие общей природы механизма синтеза белка является одним из великих достижений современной науки, сравнимым с изучением открытого космоса. Количество белка, синтезируемого в сутки, зависит от потребностей в нем организма для роста, образования пищеварительных и других ферментов, а также для замещения белков, распавшихся в клетках различных тканей. Слизистая тонкого кишечника возобновляется каждые один или два дня. Эритроцит живет около 120 дней. Альбумин плазмы синтезируется со скоростью около 10 г в день, а фибриноген — около 2 г в день.
Потребности в белках и аминокислотах
Расчетные минимальные потребности белка в рационе составляют 0,45 г/кг массы тела. В 1985 г. международный комитет, созданный под эгидой Всемирного совета по питанию, Всемирной организации здравоохранения и Организации Объединенных Наций, опубликовал новые данные о безопасном количестве белка, потребляемого человеком. Они предполагают использование незаменимых аминокислот и адекватное энергообеспечение.
Было сделано заключение, что потребности взрослого человека в среднем составляют 0,75 г белка на 1 кг массы тела. Изучались и белковые потребности других возрастных групп. Расчет суточной белковой потребности для младенца в первый месяц жизни составляет 2,5–3 г/кг, в течение последующих 6 мес эта величина снижается до 2 г/кг. После первого года жизни потребности ребенка определить труднее, но, по-видимому, они постепенно снижаются с 2–1,8 г/кг в период от первого до второго года жизни до 0,8 г/кг для взрослого человека. Во время болезни и выздоровления желателен прием 1–1,5 г/кг.
Потребности в белке и аминокислотах при заболеваниях
Существуют две трудности в определении белковых потребностей при наличии того или иного заболевания: разные болезни в различной степени влияют на белковые потребности; это также зависит от степени тяжести недуга.
При лихорадке, переломах, ожогах и хирургических вмешательствах, белок тела интенсивно теряется во время острой фазы болезни и должен быть восстановлен в процессе выздоровления. В результате возникают две проблемы: определение нутритивных потребностей в острой фазе заболевания и определение потребностей в процессе выздоровления.
Потери белка при острых заболеваниях могут быть значительными. Имеются различные мнения относительно высокого потребления белка. Однако, бесспорно, такие потери необходимо восполнять в процессе выздоровления.
Методы оценки нутриционного статуса
Антропометрия. Антропометрия отражает изменения измеряемых анатомических параметров, связанных с изменением нутриционного статуса.
Масса тела — наиболее часто используемый в клинической практике параметр, хотя мы все еще далеки от идеального положения дел, когда пациент имеет в эпикризе данные о массе тела.
Индекс массы тела (ИМТ). Отношение массы к росту — масса (кг)/рост (мІ) — обычно выражается в такой форме, что позволяет сравнивать оба пола и большинство возрастных групп в следующих пределах значений:
20–25 — нормальное питание;
> 30 — повышенное питание;
18–20 — возможное истощение;
< 18 — истощение.
Потребление пищи. Формальная количественная оценка потребления пищи должна быть неотъемлемой частью оценки нутриционного статуса. Для этого дневник приема пищи в течение 3–7 дней ведет сам пациент или его родители. Дневник помогает не только определить текущий статус, но и помогает выяснить, улучшается или ухудшается нутриционный статус пациента.
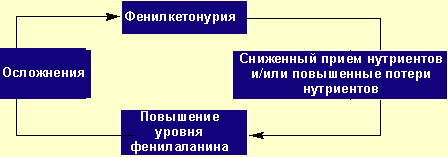
У истощенных пациентов нарушены физиологические функции. Такие больные подвержены высокому риску осложнений и неблагоприятного исхода заболевания. К тому же болезнь сама предрасполагает к развитию недостаточности питания (рис.).
Функциональные тесты по иммунной функции. Chandra показал тесную взаимосвязь между тестами, которые отражают состояние клеточного иммунитета, и степенью недостаточности питания. Лимфоциты в количестве 900–1500 клеток/ммІ указывают на умеренную недостаточность питания, а значения < 900 клеток/ммІ свидетельствуют о тяжелой степени недостаточности питания. Пропорция и количество Т-лимфоцитов в периферической крови в случае недостаточности питания также снижены. Функция лейкоцитов, секреция антител и уровни комплемента могут быть нарушены.
Лабораторные параметры. Основным параметром для больных фенилкетонурией остается уровень фенилаланина в периферической крови.
Сывороточный альбумин отражает тяжесть воспалительного заболевания, травмы и т. д., а не степень недостаточности питания, хотя замедленное возвращение показателя сывороточного альбумина к нормальным значениям после острой фазы заболевания может быть следствием неадекватного потребления белка и энергии с пищей.
Более точно определить состояние нутритивного статуса позволяют белки с более коротким периодом полураспада, преальбумин (2 дня) и трансферрин (7 дней), так же как и альбумин, подвержены сильному влиянию перераспределения и разведения, но они в большей степени отражают нутриционный статус.
Суммируя вышеизложенное, попробуем определить тактику врача — генетика в ситуации гиперкатаболизма (повышенный расход белка и энергии) у ребенка с фенилкетонурией.
При любом возникшем заболевании, повышении физической активности, потере аппетита (например, на фоне ОРВИ) ребенок недополучает белок и энергию. Запас гликогена невелик. Наиболее доступный источник белка — скелетная мускулатура (в более серьезных ситуациях начинают страдать кишечник и далее — внутренние органы). Результатом катаболизма становится повышение уровня фенилаланина в анализах периферической крови.
Простым, логически правильным решением будет увеличение энергетической и белковой поддержки. Потребности в белке в период заболевания и восстановления увеличиваются на 1–1,5 г/кг массы тела. Таким образом, ребенок должен получать еще 20–50 г белка лечебного питания дополнительно. Одновременно необходимо снизить на время, до нормализации уровня фенилаланина, потребление натурального белка на 20–50%.
Наиболее емким энергетическим субстратом являются жиры. При метаболизме 1 г жира выделяется 9 ккал энергии. Вторым по значимости источником энергии являются углеводы — при метаболизме 1 г углеводов выделяется 4 ккал. На фоне заболевания ребенок должен получать помимо возрастной нормы базовой энергии дополнительно 10–15 ккал/ кг.
Распределение энергии по нутриентам в диетотерапии осуществляется в следующей пропорции: белки — 10–15%, жиры — 35–40% и углеводы — 45–55%.
Приведем приблизительный расчет питания для ребенка с фенилкетонурией на фоне гиперкатаболического состояния.
Ребенок 5 лет, ~ 20 кг, уровень фенилаланина периферической крови — 10 мг%, MD мил ФКУ-1 (1 банка 400 г):
- фенилаланин/сут - 300 мг;
- белок естественных продуктов - 300 : 50 = 6 г - 2 г = 4 г;
- необходимое количество белка в сутки + 1 г/кг массы в сутки в период заболевания и восстановления - 30 г + 20 г = 50 г;
- необходимое количество белка специальной формулы - 46 г;
- объем формулы в сутки - 100 г MD мил ФКУ-1 - 20 г белка; 230 г MD мил ФКУ-1 - 46 г белка;
- суточный каллораж + 15 ккал/ кг массы тела в сутки в период заболевания и восстановления - 1700 ккал + 300 ккал = 2000 ккал;
- распределение энергии: белки - 10% - 200 ккал (50 г); жиры - 35% - 805 ккал (89 г); углеводы - 55% - 1100 ккал (275 г).
Ребенок 12 лет, ~ 46 кг, уровень фенилаланина периферической крови — 15 мг%, MD мил ФКУ-3 (1 банка 400 г):
- фенилаланин / сут - 400 мг;
- белок естественных продуктов - 400 : 50 = 8 г - 3 г = 5 г;
- необходимое количество белка в сут-ки - 45 г + 46 г = 91 г;
- необходимое количество белка специальной формулы - 86 г;
- объем формулы в сутки - 100 г MD мил ФКУ-3 - 69,1 г белка; 124,5 г MD мил ФКУ-3 - 86 г белка;
- суточный каллораж + 15 ккал/кг массы тела в сутки в период заболевания и восстановления - 2500 ккал + 460 ккал = 2960 ккал;
- распределение энергии: белки - 12% - 364 ккал (91 г); жиры - 35% - 1036 ккал (115 г); углеводы - 53% - 1570 ккал (392 г).
Несмотря на то, что в наши дни врачи располагают необходимыми методиками для определения потребностей ребенка с фенилкетонурией, сохраняется определенный разрыв между знанием и практикой, что влечет за собой негативные клинические и экономические последствия. Специалистам следует иметь в виду, что постоянный мониторинг нутритивной поддержки при фенилкетонурии необходим, чтобы ребенок был обеспечен полноценным питанием.
Е. В. Денисенкова
Е. П. Клыкова, кандидат медицинских наук
Центр неонатального скрининга РФ, детская психиатрическая больница № 6, Москва
Приложения
-
- Нутритивная терапия фенилкетонурии в стрессовых ситуациях - Рисунок. «Порочный круг» некорректной нутритивной поддержки
-
- Нутритивная терапия фенилкетонурии в стрессовых ситуациях - Таблица 1. Теоретические резервы для организма ребенка весом 32 кг
Субстраты Вес субстратов, кг Содержание энергии, ккал Жир 7,5 70 500 Белок 6,0 24 000 Гликоген (мышцы) 0,25 1000 Гликоген (печень) 0,1 400 Глюкоза (внеклет. жидк.) 0,01 40 Всего 95 940









