В настоящее время, по данным отечественных и зарубежных исследователей, распространенность пищевой аллергии колеблется в широких пределах — от 0,01 до 50% — и в среднем составляет у детей 10%, у взрослых 2%. Как показали наши исследования, чаще аллергические реакции на пищевые продукты отмечаются у больных с аллергическими заболеваниями и патологией ЖКТ и гепатобилиарной системы. Так, при атопическом дерматите пищевая аллергия отмечается в среднем у 48%, среди больных поллинозом — у 45%, крапивни-цей — у 63%, бронхиальной астмой — у 15%, аллергическим ринитом — у 15%. Среди больных с заболеваниями желудочно-кишечного тракта и гепатобилиарной системы распространенность аллергии к продуктам питания выше, чем у лиц, не страдающих этой патологией, и колеблется от 5 до 50% (А. Ногаллер, 1983).
В классификации побочных реакций на пищу, принятую за рубежом, выделяют следующие реакции: истинная пищевая аллергия (ИПА); пищевая псевдоаллергия, или ложная пищевая аллергия (ЛПА); пищевая непереносимость; токсические пищевые реакции; анафилактический шок.
Согласно общепринятой классификации ЕААСI, 1994, к реакциям непереносимости пищевых продуктов можно отнести реакции на пищу токсического и нетоксического характера. Среди нетоксических реакций на пищу выделяют непереносимость пищевых продуктов, обусловленных нарушениями в системе иммунитета (пищевая аллергия) и реакции неиммунологического характера (пищевая непереносимость).
Важное значение в формировании сенсибилизации к пищевым продуктам имеет генетически детерминированная предрасположенность к аллергии.
Факторы, способствующие развитию пищевой аллергии, общие для взрослых и детей. В первую очередь, это повышение проницаемости слизистой кишечника для нерасщепленных белков, которое отмечается при воспалительных заболеваниях желудочно-кишечного тракта. Беспорядочное питание, редкие или частые приемы пищи приводят к нарушению секреции желудка, развитию гастрита, гиперсекреции слизи и другим расстройствам, способствующим формированию пищевой аллергии или псевдоаллергии.
На формирование гиперчувствительности к пищевым продуктам белковой природы оказывают влияние не только количество принятой пищи и нарушения диеты, но и кислотность желудочного сока (А. Уголев, 1985).
Пищевая аллергия может развиваться при генетически детерминированной антигенспецифической предрасположенности к формированию аллергии на пищевые антигены с участием антител класса IgE.
Наряду с IgE-антителами, существенное значение в механизме развития пищевой аллергии имеют антитела класса IgG4, особенно при аллергии к молоку, яйцам, рыбе.
Некоторые пищевые добавки могут выполнять роль гаптенов, особенно азо-красители (в частности, тартразин), образуя комплексы с протеином, например с сывороточным альбумином. Существование антител класса IgE против тартразина было продемонстрировано в экспериментах на животных, выявлялись они и у человека при помощи РАСТ. Возможно также развитие гиперчувствительности замедленного типа, проявляющейся в виде экземы, при употреблении пищевых продуктов, содержащих азо-красители, бензилгидроокситолуен, бутилгидроксианисол, хинин и др.
У 70% больных непереносимость пищевых продуктов обусловлена участием неиммунологических механизмов, среди которых особое место занимает ложная пищевая аллергия.
В основе развития ЛПА лежит неспецифическое высвобождение медиаторов (в основном гистамина) из клеток-мишеней аллергии. Псевдоаллергические реакции в виде крапивницы, головной боли, головокружения, диспепсических нарушений, вегетососудистых реакций и др. могут возникать при употреблении продуктов, богатых тирамином.
Нередко причиной развития ЛПА является не сам продукт, а различные химические добавки, вносимые для улучшения вкуса, запаха, цвета, обеспечивающие длительность хранения (красители, ароматизаторы, антиоксиданты, эмульгаторы, ферменты, загустители, бактериостатические вещества, консерванты и др.).
Необходимо отметить, что деление пищевой аллергии на истинную и ложную весьма условно. У одного пациента могут развиваться реакции на пищевые продукты, обусловленные участием и специфических реакций иммунитета, и псевдоаллергических.
Выделяют системные и локальные аллергические реакции после воздействия пищевого аллергена. Системные аллергические реакции на пищу могут развиваться и протекать с преимущественным поражением различных органов и систем. Самое тяжелое проявление пищевой аллергии — это анафилактический шок. Анафилактический шок при пищевой аллергии протекает так же, как и при других атопических заболеваниях, и отличается скоростью развития (от нескольких секунд до 4 ч), тяжестью течения (коллапс, асфиктический синдром, потеря сознания, судорожный синдром, генерализованная крапивница и ангионевротический отек Квинке, диарея, рвота, непроизвольное мочеиспускание и дефекация и др.), серьезным прогнозом (летальность при анафилактическом шоке колеблется от 20–40% и может достигать 70%). В отличие от ИПА, при ЛПА на пищевые продукты системные реакции могут проявляться в виде анафилактоидного шока. Анафилактоидный шок, вызванный потреблением пищевого продукта, по клиническим симптомам может напоминать анафилактический шок, но отличается от последнего отсутствием полисиндромности и благоприятным прогнозом. К наиболее частым гастроинтестинальным клиническим проявлениям пищевой аллергии относятся рвота, колики, анорексия, запоры, диарея, аллергический энтероколит.
Принципы диагностики пищевой аллергии остаются теми же, что и для всех аллергических заболеваний, и направлены на выявление специфических аллергических АТ или продуктов специфического взаимодействия АТ с АГ, а также на выявление реакций на пищевые продукты, протекающих по гиперчувствительности замедленного типа. При диагностике пищевой аллергии особое внимание уделяют анамнезу жизни и болезни, аллергологическому, пищевому и фармакологическому анамнезу, результатам специфического аллергологического обследования и клинико-лабораторных данным.
Дифференциальную диагностику пищевой аллергии следует проводить с заболеваниями ЖКТ, психическими нарушениями, метаболическими нарушениями, интоксикациями, инфекционными заболеваниями, аномалиями развития ЖКТ, недостаточностью эндокринной функции поджелудочной железы, целиакией, ИДС, передозировкой лекарственных средств, дисахаридазной недостаточностью, эндокринной патологией, синдромом раздраженной кишки и др. Учитывая важнейшую роль заболеваний ЖКТ в механизме ИПА и ЛПА, всем больным с непереносимостью продуктов питания рекомендована консультация гастроэнтеролога.
Основными принципами лечения пищевой аллергии являются комплексный подход и этапность в проведении терапии, направленные как на устранение симптомов аллергии, так и на профилактику обострений.
При ИПА, как и при любом другом аллергическом заболевании, применяются специфические и неспецифические методы лечения.
Неспецифические методы, или фармакотерапия, направлены на устранение симптомов развившегося заболевания и на профилактику обострений.
Ввиду важнейшей роли гистамина в развитии как ИПА, так и ЛПА особая роль в лечении заболевания отводится антигистаминным препаратам. Среди антигистаминных препаратов можно выделить 3 основные группы лекарственных средств, используемых в лечении аллергических заболеваний: препараты, блокирующие Н1-гистаминовые рецепторы (антигистаминные препараты первой и второй или новой генерации), препараты, повышающие способность сыворотки крови связывать гистамин (в частности, гистаглобулины), препараты, тормозящие высвобождение гистамина из тучных клеток (кетотифен, кромолин-натрий и др.).
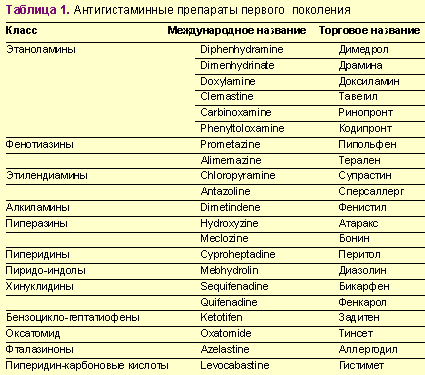
Выделяют 2 поколения антигистаминных препаратов, блокирующих гистаминовые рецепторы, — блокаторы Н1-рецепторов, широко использующиеся в лечении аллергических заболеваний вообще и пищевой аллергии в частности. Антигистаминные препараты первого поколения относятся к числу наиболее используемых в мире в течение нескольких десятков лет, которые нередко отпускаются без рецепта врача и которые вызывают целый ряд побочных эффектов (среди них наиболее выраженный — седативный эффект), ограничивающих их применение в клинике (табл. 1).
В начале 80-х гг. в практику клинической аллергологии были введены антигистаминные препараты второй генерации (табл. 2).
Антигистаминные препараты второго или нового поколения по способности блокировать периферические Н1-рецепторы сопоставимы с препаратами первого поколения, но они не проникают через гематоэнцефалический барьер и поэтому не вызывают седативного эффекта.
В настоящее время к антигистаминным препаратам предъявляют строгие требования, прежде всего они должны обладать: высокоселективной блокирующей Н1-гистаминовой активностью, высокой клинической эффективностью при аллергических заболеваниях (КАР, САР, ХРК и др.), высоким профилем безопасности, быстрым всасыванием и началом действия, высокой биодоступностью и длительным периодом полувыведения, позволяющими добиться длительного клинического эффекта после однократного введения (не менее 24 ч), возможностью использования вместе с другими группами медикаментов (антибиотики, противогрибковые, сердечные средства и др.), возможностью изменения дозы препарата при нарушениях функции ЖКТ, гепатобилиарной, мочевыделительной, сердечно-сосудистой систем и др., в пожилом и старческом возрасте, отсутствием тахифилаксии, кумуляции и проч.
Лоратадин (кларитин, ломилан) — высокоизбирательный неседативный Н1-антагонист второго поколения. Относится к метаболизируемым Н1-антагонистам. Взрослым и детям старше 12 лет препарат назначают в таблетках или сиропе, в суточной дозе 10 мг (1 таблетка или 2 чайные ложки сиропа) 1 раз/ сут. Детям в возрасте от 2 до 12 лет препарат назначают по 5 мг 1 раз/сут (1/2 таблетки или 1 чайная ложка сиропа).
Эбастин представлен единственным препаратом — кестином, не имеющим генерических копий. Молекула эбастина имеет уникальное строение, что обеспечивает ее высокую селективность и прочность связи с Н1-рецепторами к гистамину. Особенности строения кестина позволяют ему связываться с субвариантами Н1-рецепторов, недоступными другим Н1-блокаторам. Помимо антигистаминной активности кестин подавляет выделение медиаторов воспаления (простагландины, лейкотриены, интерлейкины и др.). Метаболизм эбастина начинается в тонком кишечнике, в кровь значительная часть препарата поступает в виде активного метаболита — карэбастина, что обусловливает быстрое начало действия препарата (в течение первого часа после приема) и, в отличие от ряда антигистаминных препаратов «скорой помощи», сохраняет уровень действия стабильно высоким не менее суток, а после 5-дневного курса лечения кестином его антигистаминная активность продолжается в течение 3 сут. При почечной и печеночной недостаточности концентрация карэбастина в крови не превышает терапевтических значений при приеме эбастина в дозе 10 мг/сут и не требует коррекции дозы. Кестин — единственный антигистаминный препарат второго поколения, разрешенный (вследствие его безопасности, в том числе по отношению к сердечно-сосудистой системе) к применению в двойной дозировке — 20 мг. Кестин в дозировке 20 мг является самым мощным антигистаминным средством нового поколения и может применяться для быстрого и эффективного снятия симптомов аллергии. Кестин относится к одним из самых неседативных антигистаминных препаратов нового поколения, что позволяет пациенту вести активный образ жизни, управлять автомобилем и механизмами, а также выполнять действия, требующие повышенного внимания. Эбастин не взаимодействует с этанолом и этанолсодержащими препаратами. В России кестин разрешен к применению у детей с 6 лет; детям от 6 до 11 лет назначается в дозе 5 мг/ сут, предпочтительно в форме сиропа.
Цетиризин (зиртек) является селективным блокатором Н1-рецепторов, не оказывает существенного седативного эффекта и, как другие представители нового поколения, не имеет антисеротонинового, антихолинергического действия, не усиливает действие алкоголя. Взрослым и детям старше 6 лет цетиризин назначают в таблетках или каплях, по 10 мг/сут (1 таблетка или 20 капель). Детям от 2 до 6 лет зиртек назначают в каплях, по 5 мг (10 капель) 1 раз/сут или по 5 капель (2,5 м) 2 раза/сут.
Акривастин (семпрекс) по своим свойствам близок к Н1-антагонистам второго поколения, но обладает слабовыраженными антихолинергическими и седативными свойствами. Для достижения клинического эффекта препарат семпрекс применяют по 1 капсуле 3 раза в день. Детям до 12 лет семпрекс не назначается.
Фексофенадин обладает всеми преимуществами Н1-антагонистов второго поколения. При аллергическом рините взрослым и детям старше 12 лет фексофенадин назначают в таблетках в дозе 120 мг 1 раз/сут. При хронической рецидивирующей крапивнице взрослым и детям старше 12 лет телфаст назначается в таблетках в дозе 180 мг 1 раз/сут. Для детей от 6 до 11 лет рекомендованная доза составляет 30 мг 2 раза/сут.
Антигистаминные препараты местного действия. Преимуществами топических (местных) антигистаминных средств являются исключение побочных эффектов, которые могут возникать при их системном применении, легкое достижение высоких местных концентраций препарата на слизистых и скорость развития терапевтического эффекта. К локальным антигистаминным препаратам относятся гистимет, аллергодил.
Специфическими методами лечения пищевой аллергии являются элиминация пищевого аллергена и АСИТ. Эти методы лечения применяет врач аллерголог-иммунолог в условиях аллергологического кабинета.
Л. В. Лусс, доктор медицинских наук, профессор
Приложения
-
- Проблемы пищевой аллергии в гастроэнтерологии - Таблица 1.
-
- Проблемы пищевой аллергии в гастроэнтерологии - Таблица 2.










