
Эпидемический паротит (свинка, заушница) традиционно относят к числу «детских» инфекций, поскольку возбудитель заболевания, обладающий достаточно высоким индексом контагиозности, способен к быстрому распространению преимущественно среди детского контингента. Однако этот факт не исключает возможность развития заболевания у взрослых. Недостаточное внимание врачей к особенностям течения данного заболевания у взрослых таит в себе серьезную опасность из-за возможности поражения, в частности, нервной системы и репродуктивного аппарата мужчин.
Эпидемический паротит (ЭП) представляет собой острое системное вирусное инфекционное заболевание, регистрируемое чаще у детей школьного возраста и характеризующееся преимущественным поражением слюнных желез, а также других железистых органов и нервной системы.
Возбудителем эпидемического паротита (ЭП) является вирус, принадлежащий к семейству Paramyxovirus, для которого характерен выраженный полиморфизм: его размеры могут варьировать от 100 до 600 нм, а по форме представлять округлые, сферические или неправильные элементы. Геном вируса представлен одноцепочечной спиралевидной РНК, окруженной нуклеокапсидом. Антигенная структура вируса стабильна, и на сегодняшний день известен только один его серотип. Вирус обладает нейроминидазной, гемолитической и гемагглютинирующей активностью, которые связаны с гликопротеинами HN и F.
In vitro вирус ЭП культивируется на различных клеточных культурах млекопитающих и куриных эмбрионах.
Вирус ЭП нестоек во внешней среде и проявляет исключительную чувствительность к высокой температуре, ультрафиолетовому излучению, высушиванию и дезинфицирующим веществам.
Несмотря на то что в экспериментальных условиях удается воспроизвести заболевание у некоторых видов млекопитающих (прежде всего, на обезьянах), считается, что «естественным хозяином» вируса ЭП является только человек с клинически манифестными, стертыми или субклиническими формами заболевания. Выделение вируса инфицированным больным начинается уже в конце инкубационного периода (за пять—семь дней до начала заболевания) и продолжается вплоть до девятого дня от появления первых клинических признаков заболевания. Таким образом, средний период контагиозности больного для окружающих составляет около двух недель. Наиболее активное выделение вируса во внешнюю среду происходит в первые три—пять дней заболевания. В остром периоде заболевания вирус ЭП обнаруживается в слюне, а в случае развития менингита — в ликворе. Кроме того, установлено, что вирус может обнаруживаться в других биологических секретах больных: крови, моче, грудном молоке и в пораженной железистой ткани.
Восприимчивость человека к паротитной инфекции оценивается достаточно высоко (около 100%) и сохраняется на этом уровне на протяжении всей жизни, если пациент ранее не перенес ЭП или не был против него вакцинирован (см. рисунок 1). Крайне редко регистрируются случаи заболевания у детей до шести месяцев и у лиц старше 50 лет.
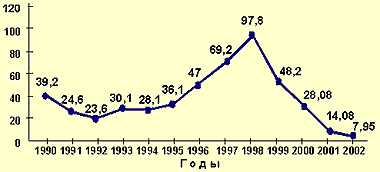 |
| Рисунок 1. Динамика заболеваемости эпидемическим паротитом в России с 1990 по 2002 гг. в показателях на 100 тыс. населения. |
Первичной локализацией возбудителя на слизистой верхних дыхательных путей с последующим поражением слюнных желез определяется воздушно-капельный путь распространения инфекции. Кроме того, допускается возможность передачи возбудителя путем прямого контакта с игрушками или посудой, контаминированных инфицированной слюной, однако следует помнить, что такой путь передачи может быть реализован только в детском коллективе, поскольку вирус ЭП нестоек во внешней среде. Одним из факторов, ускоряющих распространение вируса ЭП, является наличие сопутствующих острых респираторных инфекций — за счет существенного повышения выделения возбудителя во внешнюю среду.
ЭП относится к «управляемым» инфекциям, уровень заболеваемости которых зависит от проведения вакцинации. Но на сегодняшний день только в 38% стран мира вакцинация против ЭП включена в национальные прививочные календари (Galazka A. M. et al., 1999). Вакцинация против ЭП значимо повлияла на показатели заболеваемости. До введения обязательной вакцинации ЭП имел эпидемическое распространение преимущественно среди детей младшего школьного возраста. Подъем заболеваемости был типичен для осенних и зимних месяцев, а эпидемии повторялись через каждые два—пять лет. Из-за постоянной циркуляции вируса среди детского контингента, к 15 годам антитела к вирусу ЭП в сыворотке крови обнаруживались более чем у 90% детей. Внедрение обязательной вакцинации способствовало весомому (в десятки раз) снижению заболеваемости ЭП. В то же самое время была отмечена тенденция к изменению возрастной структуры заболевших: на фоне уменьшения заболеваемости детей вырос удельный вес заболеваемости взрослых пациентов. В условиях обязательной вакцинации случаи эпидемического распространения вируса ЭП стали регистрироваться в организованных коллективах старшей возрастной группы (воинский контингент, учащиеся колледжей и т. д.) (Caspall K. et al., 1987).
После перенесенного заболевания у больных формируется напряженный пожизненный иммунитет. В литературе имеются лишь отдельные описания повторных случаев заболевания ЭП. Хотя длительность поствакцинального иммунитета изучена недостаточно хорошо, большинство исследователей также указывают на его достаточную продолжительность.
Особую группу составляют дети до года, защита которых от заболевания ЭП обеспечивается наличием трансплацентарных специфических антител (IgG) к вирусу ЭП. Активный трансплацентарный транспорт иммуноглобулинов класса G начинается уже в шесть месяцев беременности и быстро нарастает к ее концу. В сыворотке крови плода концентрация IgG превышает материнские уровни в соотношении 1,2-1,8 : 1. В течение первого года жизни титры IgG к вирусу ЭП медленно снижаются и в возрасте от девяти до 12 месяцев выявляются только у 5,2% наблюдаемых (C. Nicoara et al., 1999).
Многие исследователи указывают на то, что хотя, в целом, уровень заболеваемости ЭП снижается, риск появления нозокомиальных форм болезни возрастает, что объясняется поздним выявлением больных, у которых заболевание протекает с развитием серозного менингита, орхита, оофарита и других осложнений (C. Aitken, D. J. Jeffries, 2001).
Воздушно-капельным путем распространения вируса ЭП определяются входные ворота инфекции: слизистая рото- и носоглотки. Экспериментально установлено, что прививка вируса ЭП на слизистую оболочку носа или щеки приводит к развитию заболевания. Первичная вирусная репликация происходит в эпителиальных клетках верхних дыхательных путей и сопровождается распространением вируса в назофарингеальные и регионарные лимфоузлы с последующей виремией и системной диссеминацией вируса. Фаза виремии непродолжительная и не превышает трех–пяти дней. В этот период происходит распространение вируса в различные органы и ткани (слюнные, половые, поджелудочную железы, центральную нервную системы и др.), воспалительная реакция в которых и определяет клинические проявления заболевания.
Несмотря на то что характер патологических изменений в пораженных органах до сих пор недостаточно изучен, в последнее время особое внимание исследователи обращают на поражение железистых клеток, тогда как ранее ведущим патоморфологическим субстратом поражения рассматривали развивающиеся в органах интерстициальный отек и лимфогистиоцитарную инфильтрацию. Исследования показывают, что хотя для острого периода типично развитие отека и лимфоцитарной инфильтрации интерстициального пространства железистой ткани, однако вирус ЭП одновременно может поражать и саму железистую ткань. Так, исследование J. Aiman соавт. (1980) показало, что при орхите, помимо отека, поражается и паренхима яичек (клетки Leydig), что обуславливает уменьшение выработки андрогенов и нарушение сперматогенеза (R. Le Goffic et al., 2003). Сходный характер поражения описан и в том случае, когда оказался затронут островковый аппарат поджелудочной железы, результатом чего может быть его атрофия с развитием диабета.
В процессе развития заболевания в организме вырабатываются специфические антивирусные антитела, нейтрализующие вирус и препятствующие его проникновению в клетки. Имеются наблюдения, что дисбаланс формирующегося клеточно-гуморального иммунитета при ЭП чаще наблюдается у лиц с более тяжелыми и осложненными формами заболевания.
Период инкубации при ЭП, в среднем, составляет 18—20 дней, хотя он может быть как укороченным (до 7—11 дней), так и более продолжительным (до 23—25 дней).
Многочисленные наблюдения показывают, что клинические проявления ЭП могут широко варьировать. Так, типичные формы ЭП (с поражением слюнных желез) регистрируются только у 30—40% инфицированных, в то время как около 40—50% заболевших переносят ЭП в атипичной форме с преобладанием неспецифических респираторных признаков болезни, а у 20% пациентов он протекает вообще субклинически. Некоторые авторы указывают на то, что процент субклинических форм среди переболевших может достигать 30%. С возрастом у пациентов увеличивается частота стертых форм заболевания, а соотношение типичных и стертых форм составляет среди детей 7—9 лет — 1:1; 10–14 лет — 1:3; и 15–19 лет — 1:11 (В. А. Постовит, 1997). Четкого объяснения данного феномена пока не существует, если не принимать во внимание традиционного — о наличии у пациентов разной степени выраженности специфического противопаротитного иммунитета.
Для ЭП типично острое начало заболевания, хотя у 15% взрослых и 5% детей заболевание может манифестировать с короткого (до одних суток) продромального периода, который крайне редко может удлиняться до двух-трех суток. Для него типичны неспецифические проявления в виде общего недомогания, головной боли, миалгий, чувства познабливания, субфебрильной температуры, анорексии и катаральных явлений.
Типичная форма ЭП характеризуется поражением слюнных желез, регистрируемых уже в первые сутки заболевания. Хотя при ЭП могут поражаться любые слюнные железы, тем не менее более специфично для этого заболевания вовлечение околоушных слюнных желез, которое у 70—80% пациентов имеет двустороннюю локализацию. При этом следует помнить, что синхронность поражения околоушных слюнных желез не типична, и интервал времени между поражением одной и другой железы может составлять от одних до трех суток.
В большинстве случаев у больных отмечается комбинированный характер поражения с вовлечением в процесс не только околоушных, но и подчелюстных и подъязычных слюнных желез. Изолированное поражение подчелюстных и подъязычных слюнных желез хотя и возможно, однако представляет большую редкость.
Развитие воспаления в слюнных железах, как правило, сопровождается лихорадкой, хотя описаны случаи, когда ЭП протекал без повышения температуры тела или с субфебрилитетом. Практически одновременно с повышением температуры до 39-40°С больные отмечают болевые ощущения в области околоушных слюнных желез, особенно при жевании и открывании рта. Болевые ощущения в области проекции околоушных слюнных желез предшествуют развитию отека железы у подавляющего большинства заболевших (свыше 90%). К числу ранних клинических признаков ЭП относится симптом Филатова (обнаружение болевых точек). Уже в течение первых суток у больных в области проекции околоушной слюнной железы появляется небольшая припухлость. Достаточно быстро (в течение нескольких часов) развивается отек, который может распространяться на область сосцевидного отростка, кпереди на щеку и на область шеи. По мере увеличения околоушной слюнной железы, мочка уха на стороне поражения поднимается вверх, придавая лицу больного типичную «грушевидную» форму. Отек околоушной железы с момента начала заболевания нарастает в течение трех—пяти дней. Кожа в области проекции воспаленной слюнной железы напряжена, лоснится, однако ее цвет не изменен. У больных отмечается умеренная болезненность при пальпации пораженной железы.
В этот период больные часто жалуются на шум и боль в ухе (на стороне поражения), что обусловлено сдавливанием отечной железой евстахиевой трубы, их беспокоят затруднения при глотании и разговоре. Описанный при ЭП симптом Мурсу (небольшая гиперемия и отек слизистой в области устья выводного стенонова протока) может выявляться, по данным разных авторов, от 5 до 80 и более процентов случаев.
Как показывают исследования последних лет, лимфатический аппарат также вовлекается в процесс при ЭП, тем не менее увеличение регионарных лимфатических узлов у больных выявляется довольно редко (от 3 до 12%), что отчасти можно объяснить тем, что камуфлируется развивающимся отеком на стороне поражения. Развитие гепатолиенального синдрома для ЭП также не типично.
Лихорадочная реакция у больных ЭП сохраняется в течение всего периода разгара заболевания, которому соответствует развивающийся отек пораженной слюнной железы. Наблюдения показывают, что у детей разрешение отека происходит уже к девятому дню болезни, тогда как у взрослых оно может наступать несколько позднее. Пролонгирование лихорадочной реакции у больных ЭП, возможно, связано с последовательным вовлечением в патологический процесс других слюнных желез либо другой локализацией процесса (орхит, ЦНС и др.). Хотя для ЭП типично одноволновое течение заболевания, описаны случаи, когда у больных регистрировались две и даже три волны заболевания.
Согласно традиционным представлениям, иная локализация патологического процесса при ЭП (кроме слюнных желез) рассматривается как осложнение заболевания. Хотя эти поражения действительно регистрируются в более поздние сроки, тем не менее современные исследования позволяют рассматривать их как более тяжелые варианты течения заболевания (В. И. Покровский, С. Г. Пак, 2003), поскольку они обусловлены специфической тропностью вируса ЭП (см. таблицу 1).
| Таблица 1. Варианты локализации инфекционного процесса у больных ЭП. | |
| Органы поражения | Частота регистрации |
| Орхит/орхоэпидидимит (у мальчиков в постпубертатном периоде) | 15-35 % |
| Оофорит (у девочек в постпубертатном периоде) | ~5 % |
| Поражение ЦНС: | |
| - менингиты | 15 % |
| - энцефалиты | <2 на 100 000 |
| - церебральная атаксия | редко |
| - парез лицевого нерва | редко |
| - миелит | редко |
| - синдром Guillain-Barre | редко |
| - гидроцефалия | редко |
| Панкреатит | 5-15 % |
| Миокардиты (по данным ЭКГ) | 3-15 % |
| Маститы | 10-30 % |
| Тиреоидиты, нефриты, артриты | редко |
Орхиты. Относятся к числу наиболее частых поражений (исключая слюнные железы) при ЭП у пациентов мужского пола в постпубертатный период и достигают 50%. В большинстве случаев поражению яичек предшествует вовлечение в процесс слюнных желез, хотя описаны случаи, когда ЭП проявлялся только развитием орхита. Чаще регистрируется одностороннее поражение яичек, хотя у 20—25% больных он может быть и двусторонним.
Орхит, как правило, развивается к концу первой недели от начала заболевания, когда у больных отмечается снижение и нормализация температуры. Больные внезапно отмечают ухудшение состояния, температура тела вновь поднимается до высоких цифр, появляется или усиливается головная боль, у больных может открыться рвота. Важнейший клинический признак — это появление ноющих болей и припухание яичек. Процесс продолжается около недели, однако припухлость яичек может сохраняться существенно дольше. Разная степень атрофии яичек регистрируется примерно у 50% больных, однако стерильность у пациентов развивается достаточно редко и только при двустороннем процессе.
Оофорит. Относится к числу нечасто встречающихся проявлений ЭП у пациентов женского пола в постпубертатный период. Более того, оофорит не влияет на фертильность и не приводит к стерильности. В некоторых случаях развитие оофорита клинически может имитировать острый аппендицит.
Маститы. Чаще развиваются в разгар заболевания на третий—пятый день ЭП. Особенностью развития маститов является то, что они могут развиваться не только у женщин, но и у девочек и мужчин. Клинически это проявляется уплотнением и болезненностью в области грудных желез.
Панкреатит. Описываемая частота развития панкреатитов у больных ЭП, по данным различных авторов, варьирует в очень широких пределах: от 1-2% до более чем 50%. Такой невероятно широкий диапазон объясняется, прежде всего, использованием различных критериев диагностики. Уровень амилазы мочи не может выступать достоверным критерием диагностики панкреатита, поскольку для паротита также характерно повышение ее уровня. Многие авторы указывают на латентное течение панкреатита при ЭП.
Поражение ЦНС может проявляться развитием серозного менингита и энцефалита.
Менингит. До введения вакцинации, вирус ЭП был одной из наиболее частых причин развития серозного менингита. Наблюдения показывают, что серозный менингит при ЭП очень часто имеет асимптоматическое течение. Исследование ликвора показывает, что у 50—60% больных ЭП отмечается развитие плеоцитоза, тогда как клинические признаки менингита (менингеальные знаки) выявляются только у 5—20% больных. У взрослых риск развития серозного менингита выше, чем у детей. Менингит может развиваться не только в периоде разгара или реконвалесценции ЭП, но даже при отсутствии у больных поражения слюнных желез. Менингит, как правило, имеет благоприятное течение, и нормализация ликвора наступает уже в течение 3—10 дней.
Несмотря на то что у пациентов с ЭП крайне редко (1:20 000) может регистрироваться такое неврологическое расстройство, как глухота, чаще возникает транзиторная нейросенсорная тугоухость, для которой, в частности, типично развитие вестибулярных нарушений в виде головокружений, нарушений статики и координации, тошноты и даже рвоты.
Энцефалиты. Относятся к числу редких проявлений при ЭП (менее чем два случая на 100 тыс.) (K. L. Davison et al., 2003). В проведенном в 1995–1998 гг. в четырех штатах США исследовании необъяснимых смертей и заболеваний с тяжелым течением, возможно, связанных с инфекционными возбудителями у прежде здоровых лиц в возрасте от одного до 49 лет, было установлено, что вирус ЭП может стать причиной ранее этиологически неустановленного поражения нервной системы (R. A. Hajjeh et al., 2002).
Энцефалит при ЭП может развиваться как параллельно с поражением слюнных желез, так и спустя одну-две недели от начала заболевания, что свидетельствует о разных механизмах его развития. Для клинической картины характерны: высокая температура, тяжелое состояние больных, заторможенность, нарушение сознания, возбуждение, клонико-тонические судороги, очаговая симптоматика. Несмотря на тяжесть поражения, летальность при паротитном энцефалите составляет от 0,5 до 2,3%.
У части больных после перенесенного энцефалита могут сохраняться длительный астенический синдром и неврологические расстройства.
Диагностика ЭП базируется на клинико-эпидемиологических данных и в типичных случаях больших трудностей не представляет.
Лабораторное подтверждение ЭП включает как выделение самого вируса (из слюны, мочи, спинно-мозговой жидкости), так и серологические исследования сыворотки крови на обнаружение специфических противопаротитных антител (IgM и IgG), что имеет особое значение в случаях атипичного и субклинического течения заболевания.
В последние годы были разработаны методы ПЦР диагностики ЭП, позволяющие не только существенно ускорить время проведения анализа, но и качественно улучшить лабораторную верификацию заболевания (G. P. Poggio et al., 2000).
Дифференциальный диагноз
Диапазон дифференциально-диагностического поиска определяется вариантом течения ЭП. Прежде всего, дифференциальный диагноз необходимо проводить у больных с односторонним поражением околоушных слюнных желез, у которых необходимо исключить иную этиологию паротита либо установить причину, имитирующую отек околоушной (или другой) слюнной железы. Увеличение околоушных слюнных желез может регистрироваться при вирусных заболеваниях, вызванных вирусами Коксаки А и лимфоцитарного хориоменингита, при бактериальном паротите, вызванном Staphylococcus aureus, сиалолитиазе, синдроме Sjogren, саркоидозе, опухолях. Особую группу составляют заболевания, при которых может выявляться псевдоувеличение околоушных слюнных желез за счет отека подкожной клетчатки или развивающегося лимфаденита: токсическая форма дифтерии, инфекционный мононуклеоз, герпесвирусная инфекция (M. D. Witt et al., 2002).
Несмотря на контагиозность ЭП, лечение больных допускается как в амбулаторных, так и стационарных условиях. Госпитализировать больных следует по эпидемиологическим и клиническим показаниям. В целях уменьшения риска развития осложнений, вне зависимости от тяжести течения заболевания, весь лихорадочный период пациенты должны соблюдать постельный режим. В острый период заболевания, в течение первых трех-четырех дней, больные должны получать только жидкую и полужидкую пищу. Учитывая нарушение саливации, большое внимание в острый период заболевания должно уделяться уходу за полостью рта (полоскание, чистка зубов, регулярный прием жидкости), а в период реконвалесценции необходимо стимулировать секрецию слюны, используя, в частности, лимонный сок.
Специфических средств лечения больных ЭП нет, хотя в экспериментальных исследованиях in vitro был установлен ингибирующий эффект рибавирина на репликацию вируса. В отличие от некоторых других «детских» инфекций, при ЭП иммуноглобулины не применяются ни для профилактики, ни для лечения.
Основу фармакологического лечения составляет патогенетическая терапия, направленная на уменьшение выраженности воспалительной реакции в пораженных органах, что достигается назначением нестероидных противовоспалительных препаратов и проведением дезинтоксикационной терапии. У пациентов с тяжелым течением заболевания с противовоспалительной целью могут применяться кортикостероидные препараты (преднизолон) в суточной дозе 40—60 мг в течение нескольких дней, однако следует помнить, что их назначение не предотвращает развитие орхитов или других локализаций процесса. Уменьшению общей интоксикации способствует достаточное употребление в течение суток жидкости в виде компотов, соков, морсов. При необходимости больным внутривенно вводят кристаллоидные (5% раствор глюкозы) и коллоидные (гемодез, реополиглюкин) растворы. Также целесообразно назначать десенсибилизирующую терапию (супрастин, димедрол и др.). Определенное облегчение приносит применение холодных компрессов или пузыря со льдом на область пораженной железы.
Противоэпидемические мероприятия направлены на изоляцию больного с целью ограничения распространения инфекции, что имеет особое значение для детей, посещающих детские сады и школы. Больные подлежат изоляции до клинического выздоровления не менее чем на девять дней от начала заболевания. Если установлена точная дата контакта ребенка, не болевшего ранее ЭП, с заболевшим, то в течение первых 10 дней от момента предположительного начала инкубационного периода они могут посещать детские коллективы, а с 11-го по 21-й дни подлежат обязательной изоляции.
Для специфической профилактики ЭП применяют живую противопаротитную вакцину, которую вводят в плановом порядке.
Литература.
- Казанцев А. П. Эпидемический паротит. - Л.: Медицина, 1988. - 176 с.
- Покровский В. И., Пак С. Г., Брико Н. И., Данилкин Б. К. Инфекционные болезни и эпидемиология. - М.: ГЭОТАР-МЕД, 2003. - С. 392-398.
- Постовит В. А. Детские капельные инфекции у взрослых. - СПб: Теза, 1997. - С. 157`-221.
- Селимов М. А. Эпидемический паротит. - М.: Медгиз, 1955. - 168 с.
- Aiman J. et al. Androgen and estrogen production in elderly men with gynecomastia and testicular atrophy after mumps orchitis.//J.Clin.Endocrinol.Metab.-1980.-v.50.-p.380-386.
- Aitken C., Jeffries D.J. Nosocomial spread of viral disease.//Clin.Microbiol.Rev.-2001.- v. 14.- p. 528-546.
- Caspall K. et al. Mumps Outbreaks on University Campuses - Illinois, Wisconsin, South Dakota.//MMWR.-1987, 36(30);496-8,503-5.
- Davison K.L. et al. Viral Encephalitis in England, 1989-1998: What Did We Miss?//EID.- 2003.-v.9.-p.234-240.
- Falk W.A. et al. The epidemiology of mumps in southern Alberta 1980-1982.//Am.J.Epidemiol.- 1989.-v.130.-p.736-749.
- Galazka A.M. et al. Mumps and mumps vaccine: a global review.//Bull.World Health Organ.-1999.-v.77.-p.3-14.
- Hajjeh R.A. et al. Surveillance for unexplained deaths and critical illnesses due to possibly infectious causes, United States,1995-1998.//EID.- 2002.- v. 8.- p.145-153.
- Hirsh B.S. et al. Mumps outbreak in a highly vaccinated population. J.Pediatr.- 1991.- v.-119.- p.187-193.
- Le Goffic R. et al. Mumps virus decreases testosterone production and gamma interferon-induced protein 10 secretion by human Leydig cells.//J.Virol.-2003.-v.77.-p. 3297-3300.
- Nicoara C. et al. Decay of passively acquired maternal antibodies against measles, mumps, and rubella viruses.//Clin.Diagn.Lab.Immun.-1999.- v.6.- p. 868-871.
- Poggio G.P. et al. Nested PCR for rapid detection of mumps virus in cerebrospinal fluid from patients with neurological diseases.// J.Clin.Microbiol.-2000.-v.38.-p. 274-278.
- Sparling D. Transmission of mumps.//N.Engl.J.Med.-1979.- v. 280.- p.276.
- Witt M.D. et al. Herpes Simplex Virus Lymphadenitis: Case Report and Review of the Literature// Clin.Infect.Dis.-2002.-v.34.-p.1-6.
В. А. Малов, доктор медицинских наук, профессор
А. Н. Горобченко, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва









