Ишемическая болезнь сердца, согласно определению экспертов ВОЗ (1995), представляет собой острую или хроническую дисфункцию миокарда вследствие относительного или абсолютного уменьшения снабжения миокарда артериальной кровью, чаще всего связанную с патологическим процессом в системе коронарных артерий.
Несмотря на достигнутые в последние десятилетия успехи в профилактике и лечении ишемической болезни сердца (ИБС), она по-прежнему представляет собой одну из актуальных проблем современной кардиологии как в России, так и во многих экономически развитых странах мира, в связи с высокой распространенностью, инвалидизацией и смертностью, преимущественно среди лиц молодого, трудоспособного возраста [1, 2, 13]. Этим обусловлена значимость проведения адекватной фармакотерапии данного заболевания.
Уровень заболеваемости ИБС в Российской Федерации составляет 93 на 100 тыс. населения, что значительно превосходит аналогичный показатель в большинстве европейских стран (1994). Наибольшее распространение до 40 тыс. на 1 млн населения [5, 13] получили хронические формы ИБС, в частности стабильная стенокардия напряжения. Именно с этой клинической формой ИБС наиболее часто приходится сталкиваться врачам амбулаторно-поликлинического звена здравоохранения.
В силу многообразия клинических форм ИБС, лечение ее включает целый комплекс мероприятий. Мы коснемся вопросов рациональной фармакотерапии стабильной стенокардии напряжения.
Среди этиологических факторов, приводящих к развитию ИБС, большая роль отводится атеросклеротическому поражению, тромбозу или патологическому спазму коронарных артерий с развитием эндотелиальной дисфункции. К усугублению нарушений коронарного кровотока может приводить выраженная гипертрофия миокарда. В ряде случаев также имеют место врожденные аномалии венечных артерий.
Основным патогенетическим фактором ИБС является нарушение кровотока в коронарных артериях, приводящее к дисбалансу между перфузией и метаболическими потребностями миокарда.
Потребность миокарда в кислороде определяется напряжением миокардиальной стенки, частотой сердечных сокращений и сократимостью миокарда и зависит от метаболических процессов, связанных в том числе и с трансмембранными токами ионов кальция, от объема желудочков сердца и от величины систолического АД. Сократимость зависит от характера органического поражения сердца. Снабжение сердечной мышцы кислородом напрямую связано с состоянием коронарного кровотока. А величина последнего зависит и от коронарного сопротивления, и от активности симпатической нервной системы, и от уровня перфузионного давления, и от гемореологических свойств крови, в частности от уровня агрегации тромбоцитов.
Согласно опубликованным данным [6, 11, 14], при выборе тактики лечения стабильной стенокардии напряжения, в том числе если у пациента риск внезапной смерти невысок, рекомендуется отдавать предпочтение медикаментозному лечению, нежели инвазивной стратегии.
Фармакотерапия предусматривает также обязательное проведение профилактических мероприятий, направленных на устранение модифицируемых факторов риска ИБС. Важная роль при этом отводится коррекции артериальной гипертонии, нормализации уровня глюкозы у больных с сахарным диабетом, отказу от курения, комплексной модификации диеты, борьбе с избыточным весом, физическим тренировкам.
Лечение стенокардии напряжения предусматривает использование различных групп лекарственных средств, воздействующих на те или иные звенья патогенеза ИБС.
- Антиангинальные средства:
- донаторы оксида азота - нитраты (нитроглицерин, изосорбида динитрат, изосорбида-5-мононитрат);
- сиднонимины (молсидомин, корватон, сиднофарм);
- β-адреноблокаторы (атенолол, бисопролол, пропранолол и др.);
- антагонисты кальция (верапамил, дилтиазем и др.).
- Противоатеросклеротические (гиполипидемические) средства (симвастатин, правастатин и др.).
- Антитромбоцитарные препараты (аспирин).
- Метаболические средства (триметазидин, триметазидин МВ).
Нитраты
Механизм антиангинального действия нитратов заключается в уменьшении потребности миокарда в кислороде, что обусловлено снижением напряжения стенки желудочков, систолического артериального давления и объема желудочков. Кроме того, антиангинальное действие реализуется путем улучшения снабжения миокарда кислородом: за счет увеличения коронарного кровотока, снижения коронарного сопротивления, уменьшения спазма коронарных артерий и увеличения коллатерального кровотока. Они обладают также ингибирующими адгезию и агрегацию тромбоцитов и, очевидно, антитромботическими свойствами. Антиагрегационные эффекты нитратов могут рассматриваться как важное дополнение их антиишемического действия.
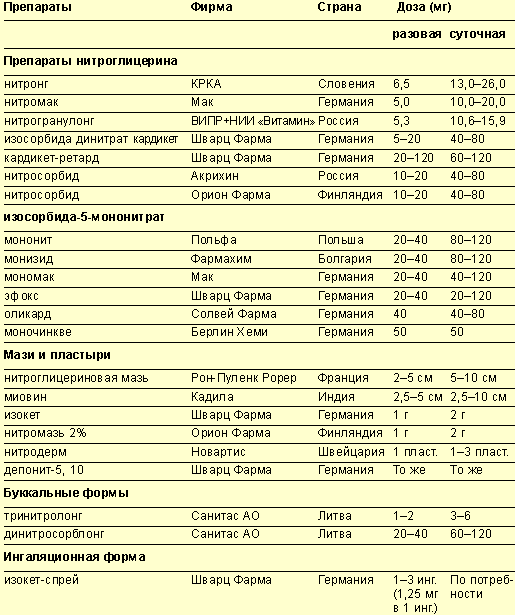
В распоряжении практикующих врачей имеется большой спектр нитропрепаратов в различных лекарственных формах и дозировках (см. таблицу 1).
Для купирования приступов стенокардии возможно применение нитроглицерина сублингвально и ингаляционно — в виде спрея.
Для профилактики приступов стенокардии целесообразно руководствоваться многоуровневой программой терапии нитратами. При стенокардии напряжения I-II ФК больным назначают заблаговременно нитраты пролонгированного действия (изосорбида динитрат или изосорбида 5-мононитрат) в виде таблеток, мазей, пластырей. При стенокардии напряжения III ФК требуется регулярный частый прием препаратов пролонгированного действия. При стенокардии напряжения IV ФК монотерапии нитратами даже в максимальной суточной дозе бывает обычно недостаточно, таким пациентам необходимо назначать комбинации из нескольких групп антиангинальных средств. Возможно одновременное применение нитратов в различных лекарственных формах (таблетки и пластыри, таблетки и спрей и др.).
В последнее время широкое распространение получили пролонгированные формы изосорбида-5-мононитрата, например оликард. Они обладают рядом преимуществ перед препаратами изосорбида динитрата — это более высокая биодоступность (до 100%), длительность антиангинального эффекта до 24 ч, более редкое возникновение побочных эффектов и меньшая тенденция к развитию толерантности.
Необходимость длительного приема нитратов в больших дозах зачастую может приводить к развитию толерантности в виде ослабления антиангинального и антиишемического действия. Толерантность чаще развивается при применении трансдермальных форм и таблетированных форм пролонгированного действия. С целью предупреждения ее возникновения рекомендуется назначать нитраты в минимально эффективных дозах, чередовать их с другими антиишемическими препаратами, использовать прерывистый режим приема нитратов, практиковать назначение препаратов-корректоров [3].
Бета-адреноблокаторы (БАБ)
Антиангинальное и антиишемическое действие БАБ заключается в их способности снижать потребление кислорода миокардом. Это осуществляется за счет снижения ЧСС, системного АД, сократительной способности миокарда. Помимо этого, БАБ обладают благоприятными эффектами, такими, как улучшение коллатерального кровообращения, антиаритмическая активность, ослабление метаболических эффектов катехоламинов.
Единой классификации БАБ не существует. С практической точки зрения их удобно разделять на группы в зависимости от наличия или отсутствия вазодилатирующих свойств, внутренней симпатомиметической активности (BCA), β1-адреноселективности, жиро- или водорастворимости.
- БАБ без вазодилатирующих свойств:
- неселективные (пропранолол, надолол, окспренолол, соталол, тимолол и др.);
- β1-селективные (атенолол, бетаксолол, бисопролол, метопролол и др.).
- БАБ с вазодилатирующими свойствами:
- неселективные (карведилол, буциндолол, пиндолол, лабетолол и др.);
- β1-селективные (небиволол, целипролол и др.).
Для длительной терапии немаловажное значение имеет лучшая переносимость β1-селективных блокаторов. В частности, частота развития таких побочных эффектов, как усталость, слабость, повышенная утомляемость, при лечении β1-селективными блокаторами ниже, чем при лечении неселективными β-адреноблокаторами.
В зависимости от степени растворимости в жирах и воде, БАБ подразделяют на три группы:
- липофильные (бетаксолол, метопролол, пропранолол и др.);
- гидрофильные (атенолол, надолол, соталол и др.);
- амфофильные (бисопролол, ацебутолол).
Индивидуальные дозы БАБ, вызывающие клинически значимую блокаду β-рецепторов у разных пациентов, варьируют. Каждому конкретному больному необходимо подбирать индивидуальную дозу, учитывая клинический эффект, ЧСС, уровень АД. Начинать лечение надо с минимальной дозы БАБ и далее титровать дозу до максимально эффективной. Индикатор эффективности — сокращение ЧСС до 52—60 уд/мин при отсутствии отрицательных симптомов, связанных с брадикардией. Опыт клинического применения БАБ при стенокардии напряжения позволяет рекомендовать их для длительной антиангинальной терапии (см. таблицу 2).
Многолетний опыт применения БАБ свидетельствует о том, что они способны улучшать отдаленный прогноз у больных ИБС. По данным ряда крупных контролируемых исследований, долгосрочное лечение БАБ способствует улучшению качества жизни и снижению смертности у больных стенокардией напряжения.
При применении БАБ без ВСА и вазодилатирующих свойств могут развиваться следующие побочные эффекты:
- отрицательный инотропный и хронотропный;
- синдром слабости синусового узла;
- атрио-вентрикулярная блокада;
- застойная сердечная недостаточность;
- артериальная гипотензия (систолическое АД ниже 100 мм рт. ст.);
- синдром отмены (рикошетная гипертензия, обострение ИБС и т. д.);
- периферические вазоспастические реакции;
- бронхоспазм;
- развитие гипогликемии;
- нарушение половой функции у мужчин (частота от 11 до 28% при длительном применении неселективного β-адреноблокатора пропранолола);
- желудочно-кишечные нарушения (чаще всего запоры);
- депрессия, нарушения сна, возбуждение, агрессивность, спутанность сознания.
При дифференцированном подходе к выбору БАБ с учетом характера сопутствующей патологии у больного, а также возможных побочных воздействий того или иного препарата, серьезные негативные эффекты при длительном их применении развиваются нечасто.
Так, побочные эффекты при лечении β1-селективными блокаторами возникают менее чем у 15% больных, причем отменять препараты приходится лишь в 1-2% случаев. У лиц пожилого возраста следует иметь в виду возможность неблагоприятного воздействия β-адреноблокаторов на центральную нервную систему (сонливость, бессонница, кошмарные сновидения, галлюцинации, психическая депрессия).
Антагонисты кальция (АК)
АК представляют собой большую и весьма неоднородную по химической структуре и фармакологическим свойствам группу лекарственных препаратов, общим свойством которых является конкурентный антагонизм в отношении потенциал-зависимых кальциевых каналов.
Механизм действия АК заключается в том, что они уменьшают потребность миокарда в кислороде за счет снижения АД, ЧСС и сократительной способности миокарда. Увеличение доставки кислорода к миокарду осуществляется за счет снижения коронарного сопротивления и устранения спазма коронарных артерий, улучшения коронарного кровотока и увеличения коллатерального кровообращения. Имеют значение также улучшение диастолической функции миокарда, антиаритмическая эффективность (для верапамила и дилтиазема), уменьшение накопления кальция в ишемизированных кардиомиоцитах, антиагрегационные и антиатерогенные свойства АК.
Блокаторы медленных кальциевых каналов условно можно разделить на учащающие пульс АК (дигидропиридиновые — нифедипин, амлодипин, исрадипин и др.) и замедляющие пульс (верапамил, дилтиазем). У больных со стабильной стенокардией напряжения могут использоваться все АК. Однако нужно помнить, что дигидропиридиновым АК следует отдавать предпочтение у тех больных, которым противопоказано применение БАБ: например, при выраженной синусовой брадикардии, при синдроме слабости синусового узла, при замедлении атриовентрикулярной проводимости, при бронхиальной астме, при нарушениях эректильной функции на фоне приема БАБ. Применять следует преимущественно пролонгированные дигидропиридины (например, амловас) или ретардные формы нифедипина.
По данным контролируемых исследований, у больных ИБС со стабильной стенокардией рекомендуемые эквивалентные дозы АК составляют: для нифедипина 30—60 мг/сут, верапамила — 240—480 мг/сут, дилтиазема — 90—120 мг/сут, амлодипина 5—10 мг/сут.
Побочные эффекты АК можно разделить на следующие группы:
- связанные с вазодилатацией (головная боль, головокружение, приливы крови к лицу, сердцебиение, периферические отеки), более характерные для короткодействующих производных дигидропиридина;
- отрицательные ино-, хроно- и дромотропные воздействия, присущие верапамилу и, в меньшей степени, дилтиазему;
- желудочно-кишечные расстройства (запор, диарея, тошнота, рвота и др.), чаще всего встречающиеся у пожилых больных при лечении верапамилом;
- развитие толерантности (при лечении нифедипином).
Гиполипидемические средства
В настоящее время доказано, что нарушения в спектре и уровне липидов плазмы крови человека относятся к факторам повышенного риска развития и прогрессирования ИБС. Коррекция нарушений липидного обмена и нормализация уровня атерогенных липопротеидов низкой плотности позволяют снизить смертность от ИБС, частоту острых коронарных осложнений, замедлить прогрессирование ангиографических проявлений коронарного атеросклероза. Это дает основание рекомендовать обязательное включение гиполипидемических препаратов в лечебную программу больных ИБС, имеющих нарушения липидного спектра крови [4].
Наиболее эффективными из использующихся в настоящее время гипохолестеринемических средств являются статины. Механизм их действия заключается в том, что они ингибируют активность фермента ГМГ — Ко А — редуктазы в клетках печени и таким образом снижают синтез холестерина в клетках печени. В результате синтезируется больше белка для рецепторов ЛНП, который раньше подавлялся внутриклеточным ХС. Количество рецепторов значительно увеличивается, что приводит к повышенному извлечению из крови ЛНП и их предшественников — ЛОНП, так как рецепторы распознают апопротеины В и Е, которые присутствуют в обоих липопротеинах.
Таблица 3.

К статинам относятся следующие препараты: ловастатин (мевакор), флувастатин (лескол), симвастатин (зокор), правастатин (липостат, эптастатин), аторвастатин (см. таблицу 3). Эффективность статинов доказана в ходе долгосрочных мультицентровых клинических исследований. Они снижают ОХС на 20—40%, ХСЛНП на 25—45%, ТГ — на 10—20%, несколько повышают ХСЛВП — на 5—8%.
Крупные исследования, проведенные с применением различных статинов, показали, что длительный (свыше пяти лет) прием препаратов приводит к снижению частоты возникновения инфаркта миокарда соответственно на 31—34%; риска смерти от ИБС — на 28—42%. Они оказывают также антиишемическое действие у больных ИБС при приеме в комбинации с β-адреноблокаторами и нитратами.
По данным разных авторов, статины снижают ОХС на 40–60%, ХСЛНП — на 25—61%, ТГ — на 25—43%, умеренно повышают ХСЛВП в среднем на 8%.
Все статины, как правило, назначают в 19-20 ч во время ужина, так как в ночное время идет наиболее интенсивный синтез ХС.
При лечении больных ИБС гиполипидемическими средствами целевой уровень ОХ составляет < 180 мг/дл (< 5,0 ммоль/л), целевой уровень ХСЛНП — < 130 мг/дл (3,4 ммоль/л). Начинать медикаментозную терапию надо с минимальной дозы препарата, а повышать дозу при отсутствии желаемого эффекта (целевого уровня ХСЛНП) следует не ранее, чем через один-два месяца лечения. Дозу препарата можно снизить, если ОХС < 140 мг/дл (3,6 ммоль/л) или ХСЛНП < 75 мг/дл (1,94 ммоль/л).
Статины обычно хорошо переносятся. Побочные эффекты возможны в виде повышения активности трансаминаз, уровня креатинфосфокиназы или в виде изменения мышц (миозит, миалгии, мышечная слабость). Есть сообщения, что статины могут вызвать нарушения сна (укорочение), головную боль, запоры. Частота побочных реакций небольшая — 5%.
Метаболическая терапия
Лечение ИБС длительное время рассматривалось только с точки зрения улучшения гемодинамики. Действие традиционных лекарственных средств направлено в основном на снижение потребности миокарда в кислороде или на увеличение поступления кислорода. Препараты, влияющие на гемодинамические параметры, эффективны, когда речь идет о профилактике приступов стенокардии, но фактически не защищают клетку миокарда от ишемических изменений.
Метаболическая терапия направлена на улучшение эффективности утилизации кислорода миокардом в условиях ишемии.
Нормализация энергетического метаболизма в кардиомиоцитах представляет собой весьма перспективный подход к лечению больных ИБС. Одним из препаратов, обладающих цитопротекторным действием, является триметазидин (предуктал), реализующий свое действие на клеточном уровне и воздействующий непосредственно на ишемизированные кардиомиоциты [7, 10]. Высокая эффективность триметазидина в лечении ИБС объясняется его прямым цитопротекторным антиишемическим действием.
Многочисленные исследования показали, что препарат как при монотерапии, так и в комбинации с другими лекарственными средствами оказывает антиишемическое действие, уменьшая количество приступов стенокардии и увеличивая время нагрузки.
Триметазидин не менее эффективен в лечении стабильной стенокардии, чем БАБ или АК [8, 9, 12].
В клинической практике прямое цитопротекторное действие, которое оказывает триметазидин, позволяет широко назначать его практически всем больным стенокардией напряжения, среди них:
- больные со впервые выявленной стенокардией напряжения;
- пациенты, у которых не удается достигнуть терапевтического эффекта традиционными антиангинальными препаратами;
- больные, у которых традиционные антиангинальные препараты вызывают побочные эффекты: триметазидин позволяет уменьшить дозу препаратов, оказывающих побочные воздействия, улучшая общую переносимость лечения.
Существует две лекарственные формы триметазидина: предуктал назначают по 20 мг три раза в сутки, предуктал МВ по 35 мг два раза в сутки. В новой лекарственной форме с модифицированным высвобождением действующее вещество равномерно распределено в объеме гидрофильного матрикса, что обеспечивает его замедленное контролируемое высвобождение. Это позволяет увеличить плато концентрации триметазидина в крови в течение суток и дает возможность поддерживать постоянную антиангинальную эффективность триметазидина в течение 24 ч. Поскольку новая форма позволяет повысить значение минимальной концентрации на 31% при сохранении максимальной, триметазидин МВ обеспечивает лучшую защиту миокарда в ранние утренние часы. Триметазидин МВ принимается два раза в день, что обеспечивает более удобный режим дозирования и повышает приверженность больных лечению.
Триметазидин обычно хорошо переносится, не имеет противопоказаний, может применяться совместно с другими препаратами. Нежелательные явления возникают очень редко и всегда слабо выражены.
Антитромбоцитарные средства
Имеются достоверные доказательства уменьшения риска развития сердечно-сосудистых осложнений и улучшения прогноза у больных ИБС при проведении антитромбоцитарной терапии.
Аспирин (ацетилсалициловая кислота) ингибирует циклооксигеназу и синтез тромбоцитарного тромбоксана А2, оказывает антитромботическое действие.
Небольшие дозы аспирина (75—125 мг/с) наряду с известными антиангинальными препаратами целесообразно принимать практически всем больным с хроническими формами ИБС. Его влияние на степень сердечно-сосудистого риска удалось продемонстрировать в ряде длительных контролируемых исследований. Так, риск развития инфаркта миокарда у больных со стабильной стенокардией снизился в среднем на 87% при долгосрочном (до шести лет) приеме аспирина, после инфаркта миокарда смертность снижается на 15%, частота развития повторного инфаркта миокарда — на 31%.
Дипиридамол (курантил) в качестве антитромбоцитарного средства применяется реже, чем аспирин, так как его использование ограничено из-за возможного синдрома «обкрадывания».
Контроль за эффективностью лечения у больных стабильной стенокардией проводят на основании динамики стенокардического синдрома (оценивают количество приступов стенокардии и потребность в короткодействующих нитратах), динамики количества болевых и безболевых эпизодов ишемии миокарда по данным холтеровского мониторирования ЭКГ, динамики толерантности к физической нагрузке по данным нагрузочных тестов.
При лечении осложнений, таких, как нарушения ритма сердца или хроническая сердечная недостаточность и др., проводят специфическую терапию этих состояний.
Литература.
- Оганов Р. Г. Профилактическая кардиология: успехи, неудачи, перспективы. - Кардиология, 1996. - №3. - С. 4-8.
- Оганов Р. Г., Масленникова Г. Я. Сердечно-сосудистые заболевания в Российской Федерации во второй половине ХХ столетия: тенденции, возможные причины, перспективы. - Кардиология, 2000. - №6. - С. 4-8.
- Ольбинская Л. И., Лазебник Л. Б. Донаторы оксида азота в кардиологии. - М., 1998. - 172 с.
- Ольбинская Л. И., Вартанова О. А., Захарова В. Л. Медикаментозное лечение нарушений липидного обмена. - М., 1998. - 51 с.
- ACC/AHA/ACP-ASIM Guidelines for the Management of Patients With Chronic Stable Angina. A Report of American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Committee on Management of Patients With Chronic Stable Angina). J Am Coll Cardiol 1999;33:7:2092-2197.
- Bucher HC, Hengstler p, Schindler D, et al. Percutaneous transluminal angioplasty versus medical treatment for non-acute coronary heart disease: meta-analysis of randomised controlled trials. BMJ. 2000; 321:73-77.
- Cargnoni A, Pasini E, Ceconi C et al. Insight into cytoprotection with metabolic agents. Eur. Heart J. Supplements. 1999, 1: 40-48
- Dalla-Volta S, Maraglino G, Della-Valentina P et al. Comparison of Trimetezidine with nifedipine in effort angina: double-blind, crossover study. Cardiovasc. Drugs and Therapy. 1990, 4: 853-860
- Detry J, Sellier P, Pennaforte S et al. Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol in patients with stable angina. Br. J. Clin. Pharmac. 1994, 37: 279-288
- Kantor P, Lucien A, Kozak R et al. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme A thiolase. Circulation Res. 2000, 17: 580-588
- Management of stable angina pectoris. Recommendations of the Task Force of the European Society of Cardiology. Eur Heart J. 1997;18:394-413.
- Michaelides A, Spiropoulos K, Dimopoulus K et al. Antianginal efficacy of the combination of trimetazidine-propranolol compered with isosorbide dinitrate-propranolol in patients with stable angina. Clin. Drug Invest. 1997, 13: 116-122
- The Burden of cardiovascular disease mortality in Europe, Task force of the European Society of Cardiology on Cardiovascular Mortality and Morbidity Statistics in Europe. Eur Heart J 1997;18:1231-1248.
- Williams S.V., Fihn S.D.,Gibbons R.J. Guidelines for the management of patients with chronic stable angina: diagnosis and risk stratification. Ann. Intern. Med. 2001;135:530-547.
Л. И. Ольбинская, доктор медицинских наук, профессор
Т. Е. Морозова, доктор медицинских наук, профессор
ММА им. Н. М. Сеченова, Москва
Приложения
-
- Современные аспекты фармакотерапии ишемической болезни сердца - Таблица 1. Современные нитропрепараты и их дозировки.
-
- Современные аспекты фармакотерапии ишемической болезни сердца - Таблица 2. Характеристика БАБ.










