Хорошо известно, что характер вскармливания ребенка оказывает существенное воздействие на состав кишечной микрофлоры в течение первого года жизни. В кишечнике детей, находящихся на грудном вскармливании, доминируют бифидобактерии и присутствуют энтеробактерии, в то время как у детей, вскармливающихся искусственно, — это бактероиды, клостридии и стрептококки. Грудное молоко, естественная и основная пища ребенка в течение первого года жизни, содержит вещества, которые прямо влияют на становление облигатной микрофлоры: бифидус-фактор стимулирует рост Bifidobacterium bifidum; лактоза способствует «естественному отбору» бактерий, способных утилизовать этот уникальный сахар. Косвенное воздействие лактозы заключается в том, что при ферментировании лактозы до уксусной кислоты в кишечнике повышается рН, что стимулирует рост определенных бактерий и ингибирует колонизацию многих патогенных организмов [1].
Первоначальное микробное заселение кишечника происходит в родовых путях матери, где в норме преобладают лактобактерии и присутствует значительное количество бифидобактерий, у детей, родившихся путем кесарева сечения, процесс формирования нормального биоценоза всегда бывает нарушен [2].
В первые сутки жизни заселяются аэробы, преимущественно кокки, но могут встречаться и энтеробактерии, дрожжи, условно-патогенные и патогенные микробы, обусловливающие развитие транзиторного дисбактериоза. К третьему-четвертому дню заселяются лактобактерии, стафилококки, стрептококки, эшерихии, но в это же время могут развиваться любые слабовирулентные микроорганизмы вследствие дефицита местного иммунитета слизистой оболочки ЖКТ ребенка. Транзиторный дисбактериоз длится около шести—восьми дней, в течение этого времени происходит становление кишечного биоценоза с преобладанием бифидофлоры, составляющей в норме 95—99% биоценоза [3].
Для формирования стабильной функционирующей экосистемы микрофлоры младенца необходимо:
- селективное заселение "полезных" бактерий из множества бактерий окружающей среды;
- наличие внешних источников здорового бактериального представительства (экспозиции), которыми являются мать и родственники, близко контактирующие с ребенком;
- существование бактерий-резидентов (представителей бифидофлоры);
- формирование местного иммунитета слизистой оболочки ЖКТ младенца;
- вскармливание грудным молоком [1].
Иммуногенез новорожденного имеет свои особенности. Плод получает через плаценту только IgG, причем эти иммуноглобулины выработаны иммунной системой матери в ответ на те антигены, с которыми она встречалась на протяжении жизни. Поскольку материнские IgM и IgA не проникают через плаценту, то к моменту рождения ребенок не имеет собственной защиты от кишечных инфекций [4]. Вследствие низкого содержания лимфоцитов в лимфатических узлах и селезенке, незрелости макрофагальной системы, пониженной активности комплемента, низкого уровня β-лизинов, пропердина, лизоцима и антител иммунологическая реактивность в этот период, в целом, слабая. Однако в первые часы и дни жизни лимфоидная ткань ребенка получает мощную стимуляцию микробными антигенами, исходящими, прежде всего, из кишечника (А. М. Яковлева, 1983) [4].
Интересно, что у стерильных животных снижена иммунологическая функция лимфатических узлов, уменьшены размеры селезенки, слабый лимфопоэз и, что особенно важно, изменена гистологическая структура кишечника. Определяются истончение кишечной стенки и уменьшение числа ворсинок и клеточных элементов (лимфоцитов, плазмоцитов и тучных клеток), в сыворотке крови снижено содержание общего белка, α-, β-, γ-глобулинов[3].
В результате антигенной стимуляции в организме ребенка создается и поддерживается общий пул иммуноглобулинов, а образующийся защитный слой, состоящий из слизи, секреторных IgA, IgM и микрофлоры, покрывает всю поверхность ворсин кишечника, препятствует физическому и химическому повреждению слизистой оболочки патогенными бактериями и токсинами [5].
Функции кишечной микрофлоры чрезвычайно многообразны.
- Утилизация непереваренных компонентов пищи, расщепление клетчатки, деконъюгация желчных кислот.
- Синтез всего спектра витаминов группы В (тиамина, ниацина, рибофлавина, пиридоксина, фолиевой кислоты, биотина, пантотеновой кислоты и витамина В12), витамина К, участие в обмене витаминов С и D. Бифидобактерии и пропионовые бактерии участвуют в синтезе витаминов группы В, а бактероиды являются практически единственным семейством, обеспечивающим синтез витамина К. Бактероиды и бифидобактерии в толстой кишке утилизируют такие полисахариды, как целлюлозу, пектин, мукополисахариды, муцин, арабиногалактан и др. (G.W. Tannock, 1995) [6].
- Повышение защитных свойств слизистой оболочки кишечника, стимуляция иммунного ответа, повышение фагоцитарной активности, увеличение IgA, Т-хелперов.
- Синтез антибактериальных веществ, Пробиотики и формирование микробиоценоза у детей первого года жизни органических кислот, протеаз в концентрациях, ингибирующих рост кишечной флоры.
- Конкуренция за рецепторы адгезии.
- Усиление иммунного ответа на вакцинацию [7].
Логически оправданным подходом к коррекции многих патологических состояний (вирусная или бактериальная диарея, нарушения питания, антибиотикотерапия) представляется добавление в рацион специфических непатогенных микроорганизмов (пробиотиков), противодействующих развившимся патологическим процессам.
Пробиотики — живые микробные добавки, которые благоприятно влияют на организм человека путем формирования полноценного барьера слизистой оболочки кишечника, препятствующего прикреплению к ней патогенов, модуляции защитных механизмов организма и улучшения баланса кишечной микрофлоры. Это достигается посредством либо прямого антагонизма бактерий, либо увеличения эффективности иммунного ответа [8].
Современными требованиями к пробиотикам являются натуральное происхождение, устойчивость к действию кислоты желудочного сока и желчи, адгезия компонентов к стенкам кишечника, способность активно колонизировать кишечник, антагонизм к патогенным бактериям, достоверно подтвержденный клинический эффект и безопасность.
Некоторые пробиотики, например Bifidobacterium lactis, имеют так называемый статус GRAS, т. е. считаются безусловно безопасными для здоровья человека.
В последние годы появились рандомизированные плацебо-контролируемые исследования, демонстрирующие благоприятное влияние пробиотиков на течение диареи, пищевой аллергии, заболеваний кишечника у детей.
Исследования, проведенные у детей с диареей и жидким стулом после длительной антибиотикотерапии Vanderhoof et al. [9], продемонстрировали, что использование пробиотиков снижает частоту случаев и длительность течения диареи (см. рисунок 1).
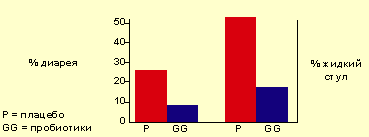 |
| Рисунок 1. Число детей (%) с диареей или жидким стулом в период проведения антибиотикотерапии. |
Пробиотики позволяют во многих случаях предотвратить развитие ротавирусной инфекции и диареи у детей, длительно пребывающих в стационаре (см. рисунок 2) [10].
 |
| Рисунок 2. Предотвращение диареи и ротавирусной инфекции при использовании смеси с добавлением пробиотиков (Нан 6-12). |
Использование пробиотиков при пероральной регидратации детей с кишечными инфекциями позволяло снизить продолжительность диареи и улучшить прибавку массы. Так, в группе детей с диареей, получающих смесь, содержащую бифидобактерии (Нан 6-12 с бифидобактериями), прибавка массы тела через 24 ч от начала терапии составила 40 г/кг/м.т. против 25,6 г/кг/м.т. в группе детей, получающих стандартную смесь [10].
Изучение состава микрофлоры у здоровых и страдающих атопическим дерматитом детей показало достоверное снижение уровня бифидобактерий и повышение уровня стафилококка у больных детей по сравнению со здоровыми. Причем снижение уровня бифидобактерий в стуле коррелировало с тяжестью кожных проявлений атопического дерматита [11]. Дополнительным доказательством роли микрофлоры в развитии аллергических заболеваний является работа Р. Kallomaki c соавт. [12], которые в рандомизированном двойном слепом плацебо-контролируемом исследовании, проведенном у детей первых шести месяцев жизни, показали, что использование пробиотиков с рождения приводит к снижению частоты и тяжести аллергических проявлений.
Один из важных механизмов действия пробиотиков заключается в продуцировании молочной кислоты и повышении кислотности содержимого желудка и кишечника. Именно поэтому в последние годы внимание исследователей вновь привлекли кисломолочные продукты, которые традиционно присутствуют в рационе многих народов без каких-либо побочных действий на протяжении многих столетий. Исследование больных, находящихся в критическом состоянии в отделениях реанимации, выявило, что кисломолочные смеси уменьшают количество патогенной флоры в желудке (см. рисунок 3).
 |
| Рисунок 3. Влияние кисломолочной смеси на бактериальную пролиферацию в желудке у больных в критическом состоянии. |
Но наибольший интерес вызывают смеси, обладающие как бы двойными функциональными свойствами, т. е. кисломолочные продукты, в которые добавлены пробиотики. Примером такой смеси является Нан кисломолочный (Нестле).
В питании грудных детей кисломолочные смеси начали использоваться с 40-х гг. прошлого века, так как именно тогда появилась первая ферментированная детская молочная смесь. За прошедший период времени многие исследователи показали целый ряд полезных для ребенка свойств кисломолочных смесей: хорошую переносимость, особенно в случае склонности к функциональным нарушениям; увеличение толерантности к инфекционным агентам; хорошее переваривание и высокую усваиваемость. Все эти свойства связаны с воздействием молочной кислоты на белок и жиры смеси [13].
Многочисленные балансовые исследования показали, что молочная кислота увеличивает всасывание жира из продукта до 94%, что несколько превышает показатели усваиваемости жира при вскармливании пресными смесями и грудным молоком. Казеин молочного белка в присутствии молочной кислоты створаживается в мелкие хлопья и легко переваривается в желудке у младенца. Скорость эвакуации кисломолочной смеси из желудка выше, по сравнению с пресной смесью [8].
Молочная кислота способствует более полному усвоению железа, фосфора и кальция. Кислая среда стимулирует рост нормальной аутомикрофлоры кишечника, улучшает перистальтику кишечника и препятствует росту патогенных бактерий, гнилостной и газообразующей флоры. В процессе сквашивания кисломолочных продуктов вырабатываются бактерицидные вещества, повышающие активность лизоцима; антибиотики (никозин, низин); ферменты (β-галактозидаза), витамины группы В, фолиевая и пантотеновая кислота [14].
Доказано, что использование адаптированных кисломолочных смесей не вызывает изменения кислотно-щелочного баланса, состояния напряженной компенсации в условиях дополнительной кислотной нагрузки, снижения уровня оснований в крови грудных детей. Это объясняется тем, что для кисломолочных продуктов характерно образование в процессе ферментации L-изомера молочной кислоты, который быстро и эффективно метаболизируется под действием лактатдегидрогеназы (известно, что молочная кислота существует в форме двух изомеров L и D, причем L-изомеры отличаются физиологическим для организма младенца путем метаболизма) [15].
Напротив, применение у детей грудного возраста столь широко распространенного в России кефира вызывает серьезные отклонения как в деятельности желудочно-кишечного тракта, так и в общем состоянии и развитии ребенка.
Использование в первом полугодии жизни кефира, равно как и цельного коровьего молока, имеющих высокий уровень белка и, соответственно, серусодержащих аминокислот (метионина и цистина), которые увеличивают кислотную нагрузку на почки, может приводить к развитию метаболического ацидоза. Следует помнить, что при небольших сдвигах кислотно-щелочного баланса основным проявлением метаболического ацидоза будут задержка роста и снижение весовой кривой. При выраженном метаболическом ацидозе появляются яркие клинические симптомы, такие, как беспокойство, гиперапноэ, срыгивания, рвота, сонливость, менингеальные знаки [13].
Установлено, что увеличение потребления кефира до 400 мл в день ведет к развитию диапедезных кровотечений в слизистой тонкого кишечника у детей первых шести месяцев жизни и, как следствие, — к значительному повышению экскреции гемоглобина с калом, приводящему к развитию железодефицитной анемии [16]. Степень тяжести анемии коррелирует с выраженностью диапедезных кровотечений (Н. Е. Малова, 2003).
В настоящее время в России появились полностью адаптированные кисломолочные смеси, полезные свойства одной из них (Нан кисломолочный с бифидобактериями) усилены благодаря добавлению живых бифидобактерий. Нан кисломолочный с бифидобактериями представляяет собой сухую кисломолочную смесь, содержащую живые бактерии Bifidobacterium lactis (Bb12) и Streptococcus thermophilus. При растворении в воде немедленно начинается процесс ферментации, который быстро снижает рН жидкой смеси. Смесь обладает высокой бактериостатической активностью, при инкубации с Pseudomonas aeruginosa при +37° в течение 3—8 ч снижает в 100 раз степень колонизации патогенного возбудителя на единицу объема. Смесь особенно показана детям с высоким риском развития инфекционного процесса. Использование этого продукта в ряде многоцентровых исследованиях в очередной раз подтвердило безопасность и благоприятное воздействие кисломолочных адаптированных продуктов на микрофлору кишечника.
Особую роль играет изучение безопасности использования пробиотиков в детском питании. Следует отметить, что на протяжении почти 40 лет (1961—1998 гг.) проведены 143 клинических испытания пробиотиков, в которых приняли участие 7500 здоровых и больных детей и взрослых. Ни одно из этих исследований не выявило побочного действия или патологической реакции на пробиотики.
По-видимому, к настоящему времени назрела необходимость пересмотра существующих рекомендаций и расширения возможностей активного использования кисломолочных смесей в педиатрической практике.
По вопросам литературы обращайтесь в редакцию
М. И. Дубровская, кандидат медицинских наук
Ю. Г. Мухина, доктор медицинских наук, профессор
О. К. Нетребенко, доктор медицинских наук
РГМУ, Москва









