В течение последних лет в г. Томске и Томской области регистрируется высокая заболеваемость хроническими вирусными гепатитами (ХВГ) В и С. Подъем заболеваемости ХВГВ в этом регионе впервые отмечен в 2002 г. [8, 9]. За период 2000–2009 гг. заболеваемость возросла с 9,35 до 35,39 на 100 тысяч населения (с пиком в 2006 г. — 45,96 на 100 тысяч населения). При этом ХВГС доминирует в структуре хронических гепатитов, его доля составляет 71,4%. Наиболее высокий уровень заболеваемости ХВГ в Томской области совпадает с возрастом 20–29 лет (37,2%) и 30–39 лет (32%). Число пациентов с ХВГ в 40–49 лет и 15–19 лет существенно ниже и составляет 9,6% и 3,4% соответственно. Среди впервые выявленных больных ХВГ женщины составляют 40,0%. [9]. Высокая распространенность ХВГ В и С среди женщин репродуктивного возраста может способствовать более интенсивной перинатальной передаче вирусов гепатитов В и С.
Известно, что, несмотря на проведение вакцинации против гепатита В, возможна вертикальная передача вируса гепатита В [2]. Установлена зависимость риска вертикальной передачи вирусов гепатита В и С от активности вирусного процесса [3] и вирусной нагрузки у матери [4, 11, 12].
Назначение препаратов интерферона при ХВГ у беременных женщин улучшает прогноз [1, 6, 7]. Интерферонсодержащим препаратом является комбинированный иммунобиологический препарат Кипферон суппозитории для вагинального или ректального введения (Кипферон®), содержащий в своем составе комплексный иммуноглобулиновый препарат (КИП), состоящий из IgG, IgA, IgM, и рекомбинантный альфа2-интерферон человека.
Установлено, что сочетание антивирусных, антибактериальных и антитоксических антител КИП, принадлежащих к разным классам Ig и, тем самым, обеспечивающих агглютинацию, нейтрализацию и преципитацию этиотропных факторов, а также антивирусного, антибактериального и иммуномодулирующего действия ИФН-альфа, позволяет проводить эффективные профилактические и лечебные мероприятия при акушерско-гинекологической патологии [5].
Целью исследования было провести клинико-эпидемиологическое обоснование необходимости применения препарата Кипферон® у беременных женщин с ХВГ В и С и оценить его профилактическую эффективность. Объект исследования: 42 ребенка с врожденными гепатитами (из них 7 — с острым вирусным гепатитом (ОВГ) В, 23 — с ОВГС; 3 — с ХВГВ, 8 — с ХВГС и 1 — с микст-гепатитом В+С), госпитализированных в детскую инфекционную больницу им. Г. Е. Сибирцева г. Томска в период с 2000 по 2009 гг., 104 беременных женщины с ХВГ В и С (из них 30 — с ХВГВ, 74 — с ХВГС), находившихся под нашим наблюдением в период с 2006 по 2009 гг., и 14 беременных женщин с реактивацией ХВГ В и С (из них 3 — с ХВГВ и 11 — с ХВГС), принимавших препарат Кипферон® и находившихся под нашим наблюдением в 2009–2010 гг.
Методы исследования: эпидемиологический (ретроспективное эпидемиологическое исследование), аналитический, клинические методы, лабораторные методы, УЗИ органов брюшной полости, определение маркерного спектра на вирусные гепатиты В и С (HBsAg, анти-HBs, HBeAg, анти-HBe, анти-HBc-IgM, анти-HBc-IgG; анти-HCV-IgM, анти-HBc-IgG, анти-HCV-NS3, анти-HCV-NS4, анти-HCV-NS5), молекулярно-биологическое исследование крови на вирусы гепатитов В и С методом полимеразной цепной реакции (ПЦР) и генотипирование вируса гепатита С. ПЦР-диагностика и генотипирование проводились в лаборатории Медицинского диагностического центра НПО «Вирион» в г. Томске. Положительные результаты ПЦР определялись при содержании вирусов гепатитов В и С, равном 1000 или более копий/мл.
Для оценки общей ситуации по распространенности инфицирования вирусами гепатитов В и С детей раннего возраста был проведен анализ динамики уровня заболеваемости острыми и хроническими вирусными гепатитами В и С в г. Томске в период с 2000 по 2009 гг.
Структура заболеваемости ОВГ В и С у детей первого года жизни в г. Томске претерпела изменения в период с 2000 по 2009 гг. В 2000–2001 гг. парентеральные ОВГ были в основном представлены ОВГВ, показатель заболеваемости ОВГВ у детей первого года жизни в г. Томске в 2001 г. достигал 94,2 на 100 тысяч населения. За счет внедрения вакцинации против гепатита В заболеваемость ОВГВ у детей первого года жизни снизилась до 15,6 на 100 тысяч населения в 2009 г. Интенсивные показатели заболеваемости ОВГС у детей первого года жизни в г. Томске варьировали от 0 в 2000 г. до 91,1 в 2004 г. (пик заболеваемости). В 2009 г. заболеваемость ОВГС составила 31,2 на 100 тысяч населения, в два раза превысив заболеваемость ОВГВ (рис. 1).
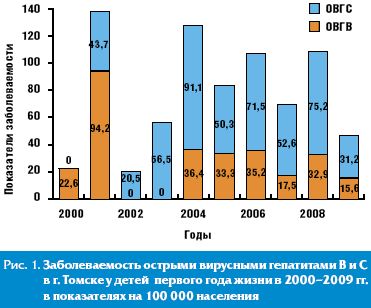
Исходом ОВГ В и С у детей первого года жизни чаще всего является формирование ХВГ [10], которые могут выявляться позднее. Был проведен анализ динамики заболеваемости ХВГ В и С в г. Томске у детей в возрасте от 0 до 2 лет жизни (рис. 2).
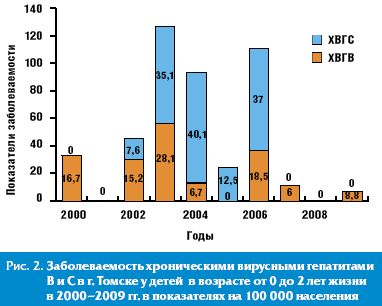
До 2002 г. заболеваемость ХВГ была представлена в основном ХВГВ. Заболеваемость ХВГС у детей этой возрастной группы начала регистрироваться в г. Томске с 2002 г., составив 7,6 на 100 тысяч населения, достигла пика заболеваемости в 2004 г. — 40,1 на 100 тысяч населения, до 2006 гг. ХВГС был доминирующим в структуре ХВГ. В 2007–2009 гг. регистрация ХВГС у детей до 2-летнего возраста не отмечалась. Однако в этот период, несмотря на проводимую вакцинацию против гепатита В, продолжал регистрироваться ХВГВ.
Для выяснения клинических проявлений и структуры путей инфицирования вирусами гепатитов В и С у детей раннего возраста были проанализированы истории болезни 42 детей с острыми и хроническими гепатитами В и С в возрасте до 2 лет. Это были 30 детей с ОВГ в возрасте от 1 до 9 месяцев жизни и 12 детей с ХВГ в возрасте от 6 месяцев до 2 лет.
Клинические проявления ОВГ и ХВГ в этой возрастной группе характеризовались малосимптомностью. Желтуха с повышением содержания в сыворотке крови общего билирубина отмечалась только при ОВГ — у 5 (16,7%) детей. Гепатомегалия по данным клинического осмотра и УЗИ органов брюшной полости была выявлена у 28 (93,3%) детей с ОВГ и у 11 (91,7%) детей с ХВГ, спленомегалия — у 21 (53,3%) детей с ОВГ и у 5 (41,7%) детей с ХВГ. Повышение уровня трансаминаз в 2–3 раза отмечалось у большинства — у 22 (73,3%) детей с ОВГ и у 7 (58,3%) детей с ХВГ. Однако высокую активность аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), с повышением более чем в 5 раз, имели только дети с ОВГ — 7 (23,3%). Нормальные показатели печеночных проб отмечались у 3 (10,0%) детей с ОВГ и у 3 (25,0%) детей с ХВГ.
При изучении эпидемиологического анамнеза было выяснено, что сведения о наличии хронических вирусных гепатитов у матери отмечены у 27 из 42 детей. ХВГВ диагностирован у 6 (22,2%), ХВГС — у 18 (66,7%), ХВГ В+С — у 2 (7,4%) матерей детей, инфицированных вирусным гепатитом. ОВГС во время беременности перенесла 1 женщина (3,7%). Половина госпитализированных детей (21 из 42) находились в специализированных детских учреждениях (областной и городской дома ребенка). Однако у всех детей маркеры вирусов гепатитов В и С выявлялись с момента рождения или поступления ребенка. Ни в одном случае у инфицированных детей не было указаний в анамнезе на искусственные (медицинские) пути заражения. Это свидетельствует о преимущественном вертикальном пути инфицирования детей раннего возраста с острыми и хроническими парентеральными гепатитами В и С, что согласуется с данными других авторов [3].
Обследование 104 беременных женщин проводилось в амбулаторных условиях. Средний возраст у беременных с ХВГ составил 28,4 ± 5,5 лет. Из них первобеременных было 58 (55,8%), повторно беременных — 46 (44,2%) женщин. ХВГ был выявлен впервые во время беременности у 92 (88,4%) женщин.
При исследовании клинических проявлений ХВГ у беременных женщин было выявлено, что состояние у всех было удовлетворительным. Активных жалоб никто из них не предъявлял. Проявлений интоксикационного синдрома, желтушности кожи не отмечалось.
Ультразвуковое исследование органов брюшной полости (УЗИ) было проведено у 16 беременных женщин с ХВГВ и у 48 беременных женщин с ХВГС. Эхоскопические изменения печени в виде неоднородности структуры были обнаружены у 4 (25,0%) женщин с ХВГВ и 12 (25,0%) с ХВГС, повышения эхогенности — у 8 (50,0%) женщин с ХВГВ и у 17 (35,4%) женщин с ХВГС, жировой гепатоз и увеличение подпеченочных лимфоузлов отмечались у 2 (4,2%) женщин только при ХВГС. Гепатоспленомегалия была выявлена по данным УЗИ только у женщин с ХВГС: гепатомегалия у 16 (33,3%), спленомегалия — у 1 (2,1%).
Положительные результаты ПЦР-диагностики в III триместре беременности были получены у 22 из 29 (78,9%) обследованных женщин с ХВГВ и у 47 из 65 (72,3%) женщин с ХВГС.
Для оценки вертикальной передачи проводилось исследование пуповинной крови новорожденных детей и в дальнейшем венозной крови в возрасте 3, 6, 12, 18 месяцев. По данным молекулярно-биологического и серологического методов исследования была подтверждена вертикальная передача у 3 из наблюдавшихся женщин. Инфицирование было выявлено у одного ребенка (1,4%), рожденного от матери с ХВГС, и у 2 (6,7%) детей, рожденных от матерей с ХВГВ. Все матери инфицированных детей имели положительные результаты ПЦР в III триместре беременности.
Для оценки профилактической эффективности препарата Кипферон® была набрана группа из 14 беременных женщин с реактивацией ХВГ В и С. Средний возраст составил 29,36 ± 1,44 года. Из них первобеременных было 3 (21,4%), повторно беременных — 11 (78,6%). ХВГВ был диагностирован у 3 (21,4%), ХВГС — у 11 (78,6%) женщин. При генотипировании был выявлен 1b-генотип у 7 (72,7%), 3а-генотип у 4 (27,7%) женщин. Положительные результаты ПЦР имели 100% женщин в 28 недель беременности. Препарат Кипферон® назначался в III триместре беременности. Положительные результаты ПЦР в 32 недели беременности имели 10 (71,4%) женщин, в сравнении с частотой положительных результатов ПЦР в 28 недель различия не были достоверными (p > 0,05). К 36 неделям беременности произошло снижение частоты выявления положительных результатов ПЦР до 50% (p < 0,05), что являлось свидетельством снижения частоты реактивации ХВГ (таблица).

Роды к настоящему времени состоялись у 8 из 14 женщин. Исследование пуповинной крови новорожденных детей показало отрицательные результаты ПЦР у всех детей, отсутствие HBsAg и HBeAg, анти-HBcore-IgM при ХВГВ у матери, отсутствие анти-HCV-IgM при ХВГС у матери. Возраст трех месяцев к настоящему времени достигнут у 4 детей. Признаков вертикальной передачи при лабораторном обследовании (молекулярно-биологическое исследование крови и серологическое исследование сыворотки крови) не зарегистрировано. Наблюдение за детьми будет продолжено до 18-месячного возраста.
Таким образом, в структуре заболеваемости ОВГ В и С у детей первого года жизни и ХВГ В и С у детей в возрасте от 0 до 2 лет в период с 2000 по 2009 гг. в г. Томске произошли изменения с увеличением доли вирусного гепатита С и снижения заболеваемости вирусным гепатитом В. Тем не менее, в условиях проводимой вакцинации против гепатита В, продолжают регистрироваться случаи ОВГВ у детей первого года жизни и ХВГВ у детей в возрасте от 0 до 2 лет. Наиболее вероятным путем заражения вирусами гепатитов В и С у детей раннего возраста является вертикальный путь. Учитывая скудную клиническую симптоматику у беременных женщин с ХВГ и у детей с врожденными вирусными гепатитами В и С, требуется тщательный вирусологический и серологический контроль этих групп пациентов. При наличии реактивации ХВГ В и С во время беременности целесообразно проведение профилактической противовирусной терапии в III триместре беременности с целью предотвращения вертикальной передачи.
Анализ предварительных данных по применению препарата Кипферон® в III триместре беременности показал снижение частоты реактивации хронических вирусных гепатитов В и С у беременных женщин, отсутствие вертикальной передачи вирусов гепатитов В и С. Требуется продолжение исследований в этом направлении для раскрытия патогенетических механизмов действия противовирусной терапии у беременных женщин с хроническими вирусными гепатитами В и С.
Литература
-
Акушерство и гинекология: Учебное пособие: В 2 т. /Алан Х. ДеЧерни, Лорен Натан: Пер. с англ.: Под общ. ред. акад. РАМН А. Н. Стрижакова. М., 2008. Т. 1: Акушерство. 776 с.
-
Базарова М. В. Клинико-эпидемиологическая оценка эффективности вакцинации против гепатита В новорожденных детей, родившихся у женщин с НВ-вирусной инфекцией: Автореф. дис. … к.м.н. М., 2002. 27 с.
-
Горячева Л. Г., Шилова И. В. Диагностика и лечение вирусных гепатитов В и С у детей раннего возраста // Terra Medica. 2007. № 2. С. 16–20.
-
Ершова О. Н. Современные проявления эпидемического процесса гепатита С, активность естественных путей передачи, совершенствование профилактики этой инфекции: Автореф. дис. … д.м.н. М., 2006. 47 с.
-
Инфекции в акушерстве и гинекологии / Под ред. О. В. Макарова, В. А. Алешкина, Т. Н. Савченко. 2-е изд. М., 2009. 464 с.
-
Кистенева Л. Б., Сускова В. С., Елец В. И. и др. Влияние виферона на частоту реализации перинатальной НС-вирусной инфекции (Материалы XIII Конгресса «Человек и лекарство»). М., 2006. С. 537.
-
Московская И. А. Болезни печени у детей / Под ред. акад. РАМН, проф. Студеникина М. Я. Тула, 2007. 536 с.
-
О санитарно-эпидемиологической обстановке в Российской Федерации в 2008 году: Государственный доклад. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009. 467 с.
-
О санитарно-эпидемиологической обстановке на территории Томской области в 2009 году: Государственный доклад. Томск: Управление Роспотребнадзора по Томской области, 2010. 215 с.
-
Учайкин В. Ф., Нисевич Н. И., Чередниченко Т. В. Вирусные гепатиты от А до TTV у детей. М., 2003. 432 с.
-
Boland G. J., Veldhuijzen I. K., Janssen H. L. und al. Beleid en behandeling bij zwargeren met hepatitis B // Ned.Tijdschr.Geneeskd. 2009. № 153. A. 905.
-
Yang S., Liu M., Wang L. Effect of high viral hepatitis B virus DNA loads on vertical transmission of hepatitis B virus in late-pregnant women // Zhonghua Fu Chan Ke Za Zhi. 2008. № 43 (5). P. 329–331.
Т. А. Ковалева, кандидат медицинских наук
К. И. Чуйкова, доктор медицинских наук, профессор
И. Д. Евтушенко, доктор медицинских наук, профессор
О. Г. Мухачева
ГОУ ВПО СибГМУ Росздрава, Томск
Контактная информация об авторах для переписки: kia@mail.tomsknet.ru
Купить номер с этой статьей в pdf
.jpg)
.jpg)
.jpg)









