Эпилепсия является одним из наиболее распространенных заболеваний центральной нервной системы (ЦНС). Ежегодный рост заболеваемости эпилепсией составляет от 40 до 70 человек на 100 тыс. населения, при этом приблизительно у 1/3 пациентов заболевание является пожизненным. По данным ВОЗ, более 75% из 40 млн больных эпилепсией в мире не получают адекватного лечения. Длительность фармакотерапии эпилепсии составляет в среднем от двух до пяти лет, однако около 40% больных вынуждены получать лечение пожизненно. В России 8,65% больных эпилепсией находятся в состоянии ремиссии, у 48,1% пациентов регистрируется более 12 приступов в год. Политерапию получают 41,18% пациентов; 18,05% не получают лекарственной терапии, остальным же проводится лечение одним препаратом. Сплошные популяционные исследования по разным регионам России показывают, что доля пациентов без припадков от общего числа больных, получавших антиконвульсантную терапию, составляет 13–28%, в то время как при правильной тактике лечения она должна составлять 50–80% [2].
На протяжении последних лет наблюдается увеличение количества новых противоэпилептических препаратов (ПЭП), из которых многие уже широко применяются на практике. ПЭП уделяется большое внимание со стороны компаний-производителей, учитывая их большой удельный вес среди других препаратов на фармацевтическом рынке. Этому есть несколько причин:
-
широкая распространенность эпилепсии;
-
необходимость длительного применения ПЭП при эпилепсии;
-
расширение показаний для использования ПЭП — лечение других неэпилептических неврологических и психиатрических нарушений, то есть потребность в ПЭП на фармацевтическом рынке возрастает [5, 15];
-
старение населения во всем мире и рост заболеваемости эпилепсией после 65 лет (количество больных эпилепсией в этой возрастной группе постоянно увеличивается) [5, 12].
Фармакоэкономические аспекты терапии эпилепсии
Эпилепсия является серьезной социально-экономической проблемой, приводящей к значительным экономическим потерям в обществе. Цена лекарства является действительно важным фактором в подборе лечения для определенных групп населения. Стоимость лекарств и расходы на лечение становятся все более важными факторами для врачей первичной медико-санитарной помощи при лечении эпилепсии. Независимое исследование, выполненное в нескольких европейских странах, определило, что прямые и непрямые расходы на лечение индивидуальных больных эпилепсией возрастают прямо пропорционально частоте припадков у них [1].
Именно пациенты с рецидивами приступов берут на себя большую часть прямых медицинских расходов. Больные, не восприимчивые к лечению, требующие постоянной терапии, частых посещений врача и непрерывного медицинского ухода, составляют примерно 75% всех прямых расходов, относящихся к эпилепсии. В популяции больных, резистентных к лечению, прямые расходы еще выше у пациентов, страдающих эпилепсией и имеющих сопутствующие болезни, такие как олигофрения, церебральный инсульт, депрессия [1].
Основой хорошей клинической эффективности является оптимальный контроль эпилептических приступов соответствующим ПЭП, используемым в дозе, максимально контролирующей приступы, но не приводящей к появлению побочных эффектов. Эти две характеристики — оптимальный контроль приступов и отсутствие побочных эффектов — определяют ценность препарата и являются критерием правильности лечения. Обе характеристики связаны с биодоступностью, из которой вытекают биоэквивалентность и терапевтическая эквивалентность ПЭП [5]. Это совпадает с фармакоэкономической эффективностью: увеличившийся процент ремиссий позволяет сэкономить дополнительные средства за счет меньшего количества амбулаторных визитов к специалистам и снижения койко-дней [1].
Терапия эпилепсии: оригинальные препараты и генерики
В настоящее время широко обсуждается проблема назначения оригинальных и генериковых препаратов в терапии эпилепсии. При регистрации препаратов-генериков допускаются отклонения в биодоступности ±20%, по сравнению с оригинальными препаратами. Однако в отношении ПЭП даже незначительное изменение биодоступности может привести не только к возобновлению, но и к повышению частоты и тяжести приступов [2, 3, 5, 6, 7].
Предыдущие клинические наблюдения указывают, что замена оригинального препарата генериком, содержащим ту же лекарственную субстанцию, может в некоторых случаях приводить к возобновлению эпилептических припадков или развитию токсических эффектов препарата. Это возникает вследствие того, что биодоступность и связанная с ней биоэквивалентность генериков отличаются от оригинальных препаратов и/или их оценка произведена недостаточно полно или правильно [5, 8, 9, 17].
В настоящее время во всем мире для контроля над судорожными и бессудорожными припадками у детей и взрослых наиболее широко применяются препараты вальпроевой кислоты (ПВК). Вальпроевая кислота используется в клинической практике для коррекции и парциальных, и генерализованных (эпилептических) приступов [3, 4]. Эффективность вальпроатов является 100% подтвержденной при контроле за абсансами, миоклоническими и тонико-клоническими судорогами при первично генерализованных формах эпилепсии, а также при парциальных приступах с вторичной генерализацией [4].
На данное время в России ПВК зарегистрированы под следующими торговыми наименованиями: оригинальный препарат Депакин (производитель — Sanofi-Winthrop Industrie, Франция) и его пролонгированные формы Депакин Хроно и Депакин Хроносфера; генерики Конвулекс (производитель Gerot Pharmazeutika GmbH, Австрия), Апилепсин (производитель KRKA d.d., Словения), Конвульсофин (владелец регистрационного удостоверения AWD.pharma GmbH & Co.KG, Германия) и ряд генериков, произведенных в Индии: Энкорат (производитель Sun Pharmaceutical Industries Ltd, Индия) и Вальпарин ХР (производитель Torrent Pharmaceuticals Ltd, Индия).
Данные исследований
Мы проанализировали доступные данные исследований зарубежных и отечественных авторов, посвященные проблеме замены ПВК в терапии эпилепсии.
Данные зарубежных авторов оказались достаточно противоречивыми. С одной стороны, в открытых рандомизированных исследованиях, проведенных у 64 больных, которые в течение 4 недель принимали оригинальный препарат ПВК, а в дальнейшем в течение 4 недель генерик, не было выявлено разницы в частоте приступов, концентрации препарата в плазме при использовании обоих препаратов [5, 18]. С другой стороны, исследования FDA в 1998 году продемонстрировали разность в биодоступности препаратов ПВК [5]. В исследованиях Mattson (2002) генерик ПВК вызывал больше побочных эффектов со стороны желудочно-кишечного тракта в сравнении с оригинальным препаратом пролонгированного действия [5, 16]. Замена оригинального препарата ПВК генериком вызвала снижение концентрации препарата в крови и появление приступов после 3-летнего бесприступного периода [5, 14].
Исследование П. Н. Власова с соавт. (2007) показало повышение обращаемости пациентов к окружному эпилептологу после перевода с оригинального препарата ПВК (Депакина Хроно) на генерики препарата (Конвулекс, Вальпарин ХР, Энкорат) в связи с неблагоприятными побочными действиями генериков (крапивница, диспептические явления, учащение приступов) [2].
Интерес представляет исследование динамики пароксизмального синдрома, ЭЭГ-параметров и показателей фармакокинетики у больных эпилепсией на фоне замены лекарственных форм пролонгированного высвобождения с Депакина Хроно на Конвулекс ретардированной формы (Т. А. Рогачева, Т. С. Мельникова, А. С. Петрухин с соавт.) [6]. В исследовании принял участие 21 пациент с различными формами эпилепсии, в возрасте от 18 до 46 лет. По результатам исследования, замена лекарственных форм пролонгированного высвобождения вальпроата натрия Депакина Хроно на Конвулекс (ретард) вызывает неблагоприятные изменения в течении пароксизмального синдрома. При этом изменения показателей биоэлектрической активности головного мозга регистрировались уже после трех дней приема Конвулекса в ретардированной форме и проявлялись усилением медленноволнового спектра дельта-, тета- и альфа-диапазонов, трансформацией медленноволновой активности в разрядную (к 14 дню терапии) с дальнейшим увеличением дизритмии и нарастанием разрядной активности. У всех больных после смены препаратов обнаруживались изменения максимальной концентрации их в сыворотке крови, которые имеют прямую зависимость с изменениями ЭЭГ-показателей. По мнению авторов, результаты проведенного исследования подтверждают существенные отличия в биоэквивалентности между исследуемыми препаратами, которые проявляются выраженными изменениями на ЭЭГ у большинства пациентов и утяжелением течения пароксизмального синдрома. Данные авторов свидетельствуют об отсутствии клинической эквивалентности между препаратами Депакин Хроно и Конвулекс (ретард), что может иметь существенное клиническое значение.
В исследовании А. В. Соколова и соавт. (2006) убедительно доказаны достоверные отличия фармакокинетических показателей различных форм ПВК с контролируемым высвобождением активного вещества [7]. Согласно полученным данным, наиболее адекватным по фармакокинетическим характеристикам оказался Депакин Хроно, динамика концентрации и режим дозирования которого полностью соответствовали заявленным фирмой-производителем. Фармакокинетические параметры других препаратов — Конвулекс, Вальпарин ХР и Энкорат Хроно — существенно отличались: они быстрее всасывались, скорость достижения максимальной концентрации в плазме крови (Сmax) была более высокой, препарат быстрее выводился из организма. Проведение терапевтического лекарственного мониторинга выявило их неэквивалентность Депакину Хроно, и, как следствие, были даны рекомендации по уменьшению разовой/суточной дозы и более частому приему ПЭП. При этом для Конвулекса разовая доза должна составлять 410 мг вместо 500 мг, а очередная доза препарата должна быть принята через 8,23 ч, а не через 12 ч, как заявлено в аннотации. Концентрации различных вальпроатов после приема однократной дозы представлены на рис.
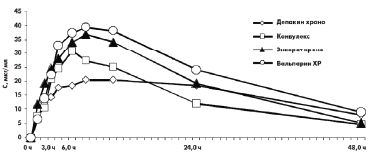
Соответственно, в наблюдениях реально повышенная разовая доза препарата и высокий уровень Сmax приводили к развитию побочных явлений, а быстрое падение концентрации и выведение препарата обусловливало срыв медикаментозной ремиссии [2, 7].
Ретроспективное исследование Ю. Б. Белоусова и А. Б. Гехт с соавт. показало фармакоэкономические преимущества при применении Депакина Хроно [1]. Общее количество припадков снижалось в среднем с 48 до 1,5 в год, что было самым низким показателем среди всех исследуемых ПЭП. Высокую эффективность авторы связывают, в первую очередь, с фармакоэкономическими свойствами: если больной забывает принять таблетку, при приеме Депакина Хроно его пролонгированное 12-часовое действие позволяет избежать пикового снижения концентрации и, соответственно, эпилептических приступов, чего невозможно добиться от ретардированной формы карбамазепинов. Это позволяет снизить количество визитов к специалистам и госпитализаций минимум в 2 раза, что значительно экономит средства.
Таким образом, данные отечественных исследований свидетельствуют о более высокой частоте возникновения неблагоприятных побочных реакций при переводе с оригинального ПВК на генерик.
Диагноз: эпилепсия. Что назначить: оригинальный препарат или генерик?
В случае назначения лечения пациенту с впервые диагностированной эпилепсией необходимо принять решение: назначить оригинальный препарат или генерик? У больных с впервые диагностированной эпилепсией лечение можно начинать с использования оригинального препарата или генерика, подобранного в соответствии с общими принципами адекватного контроля приступов без проявления побочных эффектов. В большинстве случаев контроль над приступами достигается при использовании средних дозировок препарата [5, 10, 13, 16] и вероятность колебаний концентрации ПЭП в крови не имеет такого большого значения, как, например, в случае значения концентрации препарата в плазме на уровне верхней или нижней терапевтической. То же характерно и в случае длительно текущей эпилепсии с хорошим контролем приступов при помощи средних дозировок препарата. Учитывая то, что результат лечения оценивается клинически на основании уровня концентрации препарата в крови, правильно воспроизведенный генерик — это препарат, концентрация которого в крови соответствует терапевтической, принятой и для больных с впервые выявленной эпилепсией, и для больных с хронической эпилепсией. В таких ситуациях врач может руководствоваться при назначении препарата экономическими принципами, основываясь на том, что генерик отвечает всем установленным требованиям для регистрации [5].
Однако существуют ситуации, когда генерик назначать нежелательно, так как имеется риск ухудшения клинической картины, например, при выборе препарата для больных с высоким риском ухудшения состояния. Это следующие категории пациентов:
-
больные с резистентной эпилепсией с оптимально контролируемыми приступами без побочных проявлений при приеме ПЭП. При лечении этих больных назначаются дозы ПЭП выше уровня переносимости препарата или близкие к нему [5, 16]. На практике это означает, что в крови определяется концентрация на уровне верхней (или даже выше) границы терапевтической. У таких больных даже небольшие колебания биодоступности препарата могут быть клинически значимыми. Препарат, который назначен больному вместо принимаемого ранее (генерик вместо оригинального и наоборот или один генерик вместо другого), обладающий более высокой биодоступностью (которая может не выходить за рамки принятых колебаний в ±20%), может спровоцировать токсические проявления, включая развитие ранее не регистрируемых видов эпилептических приступов. И наоборот, препарат с более низкой биодоступностью может спровоцировать учащение эпилептических приступов, которые до этого времени были хорошо контролируемыми;
-
пациенты с длительной ремиссией приступов на фоне приема низких доз препарата или в период снижения принимаемой дозы. Введение другого препарата может спровоцировать появление приступов, если ПЭП обладает более низкой биодоступностью, вследствие чего произошло слишком быстрое снижение концентрации действующего вещества в крови. В этой группе больных, в том случае, если новый препарат обладает более высокой биодоступностью, токсические эффекты развиваться не будут, так как показатели концентрации не превысят верхней границы максимальной терапевтической;
-
пациенты с измененной фармакокинетикой ПЭП. Проблемы, связанные с заменой оригинального препарата генериком и наоборот, становятся особо актуальными для беременных женщин, особенно в период перед родами, а также для рожениц, больных пожилого возраста, новорожденных и детей. У недоношенных, новорожденных и детей до одного года в связи с незрелыми системами метаболизма концентрация ПЭП в крови значительно выше, чем у детей старшего возраста и у взрослых. В течение нескольких месяцев процессы метаболизма постепенно становятся зрелыми и уровень концентрации ПЭП снижается, достигая показателей, характерных для детей. Эти показатели обычно ниже, чем у взрослых, в пересчете дозы препарата на массу тела. В связи с этим использование генериков у новорожденных и детей старшего возраста может быть связано с более высокой, чем у взрослых, разницей (достигающей 40%) концентрации препарата [5, 11].
Заключение
Результаты анализа затрат на лечение эпилепсии указывают на то, что существует следующая зависимость: стоимость лечения тем ниже, чем лучше контроль приступов. Следовательно, оптимальный контроль над приступами (с минимальным количеством побочных проявлений) — самый важный элемент, снижающий стоимость терапии. Замена одного препарата другим (оригинального генериком и наоборот или одного генерика другим) может иметь опасные последствия для течения эпилепсии (рост частоты приступов и/или побочных проявлений). Эти последствия влекут за собой непредвиденные прямые затраты, связанные с дополнительными визитами к врачу, лабораторными исследованиями, госпитализацией.
Необходимо помнить о следующих категориях пациентов с риском ухудшения клинической картины при замене оригинального ПЭП на генерик. Это больные с резистентной эпилепсией с оптимально контролируемыми приступами без побочных проявлений при приеме ПЭП; пациенты с длительной ремиссией приступов на фоне приема низких доз препарата или в период снижения принимаемой дозы; пациенты с измененной фармакокинетикой ПЭП [5].
Фармацевты не должны заменять один препарат другим без разрешения врача, а врач, в свою очередь, должен сообщить больному о возможных последствиях замены.
По вопросам литературы обращайтесь в редакцию.
Д. В. Марушкин, кандидат медицинских наук, доцент
Л. Г. Раевская
ВолГМУ, Волгоград
Купить номер с этой статьей в pdf









