Стабильная стенокардия — наиболее распространенная клиническая форма ишемии миокарда или ишемической болезни сердца (ИБС). ИБС как «самостоятельное заболевание» была выделена Всемирной организацией здравоохранения (ВОЗ) лишь в 1965 г., в связи с ростом частоты патологии и доминирующим участием в прогрессировании нарушений насосной деятельности сердца.
В настоящее время ИБС широко распространена во всем мире, особенно в экономически развитых странах, и занимает одно из ведущих мест в структуре инвалидизации и летальности от сердечно-сосудистых заболеваний (ССЗ) среди социально-значимой возрастной группы населения. В странах Северной Америки на 1 млн населения приходится 30–40 тысяч больных ИБС. Среди населения Европейского Союза смертность от ИБС составляет 744 000 случаев в год, в структуре общей смертности ИБС является причиной летального исхода у 17% мужчин и 16% женщин. ИБС — один из основных факторов риска внезапной сердечной смерти (ВСС), и на ее долю приходится 2/3 случаев внезапной смерти при ССЗ. ИБС чаще болеют мужчины в возрасте 40–65 лет [1, 2, 5, 7, 8].
Согласно рекомендациям Европейского общества кардиологов, термин «стабильная стенокардия» используется для описания клинического синдрома, который проявляется эпизодами болей или дискомфорта в области грудной клетки, боли нередко иррадиируют в нижнюю челюсть, левую руку или лопатку, провоцируются физической нагрузкой или эмоциональным стрессом и прекращаются в состоянии покоя или после приема нитроглицерина [3].
Распространенность стабильной стенокардии в странах Европы и США варьирует от 3% до 4%, и частота встречаемости увеличивается с возрастом [1, 5].
Частота сердечных сокращений (ЧСС) — физиологический параметр, наиболее часто исследуемый врачом в его ежедневной практике при оценке функционального состояния пациента. Стойкое увеличение ЧСС может свидетельствовать о наличии ССЗ. По меньшей мере 20 крупных эпидемиологических исследований, опубликованных за последние 20 лет, свидетельствуют о том, что «…повышенная ЧСС — независимый фактор риска сердечно-сосудистой заболеваемости и смертности» [1, 4, 6, 8]. Поэтому в 2007 году в новые Европейские рекомендации по профилактике ССЗ в клинической практике ЧСС включена как фактор риска наряду с такими традиционными, как артериальная гипертензия, сахарный диабет, атерогенная дислипидемия, курение [2, 3].
ЧСС — динамичный параметр и совместно с величиной ударного объема (УО) определяет эффективность насосной деятельности сердца (МО (минутный объем) (л/мин) = УО (мл) × ЧСС в минуту) адекватно «сиюминутным» метаболическим нуждам организма.
A. Boraso (2001) в своем исследовании о роли ритма сердечной деятельности в функционировании сердца как насоса, на основании данных о детерминирующем влиянии ЧСС (через активацию симпатической нервной системы), обоснованно предположил о взаимосвязи ЧСС и ожидаемой продолжительности жизни человека. Эти данные чрезвычайно важны в приложении к клинической практике [5].
Известно, что ЧСС оказывает прямое влияние на скорость метаболических процессов, лежащих в основе длительности диастолического расслабления кардиомиоцита, — «лузитропный» эффект.
Прямая взаимосвязь ЧСС и ИБС была установлена давно: в Фремингемском исследовании (1987) при 20-летнем наблюдении за 9070 пациентами была выявлена высокая положительная корреляционная связь ЧСС и ИБС [6]. В исследовании CASS (Coronary Artery Surgery Study), включающее 15-летнее наблюдение за 25 000 пациентами, был проведен анализ долгосрочной прогностической значимости ЧСС в покое на течение предполагаемой или документированной ИБС. Аналогичная тенденция отмечена и в 10-летнем исследовании The Chicago People Gas Company Stady; в исследовании NHANES I среди 1000 обследуемых лиц в течение одного года документирована прямая положительная связь ЧСС с клиническими проявлениями ИБС, которая резко возрастала при ЧСС > 84 сокращений в одну минуту [6, 7, 8, 9].
В ряде публикаций показана высокодостоверная, прямая корреляционная связь между ЧСС и частотой развития инфаркта миокарда (ИМ) в течение 5–10 лет наблюдения за пациентами. В 2005 году были опубликованы данные исследования The Cooper Clinic Mortality Risk Index, в котором, на основании разработанной системы балльной шкалы оценки вероятности смерти от всех причин среди 21 766 мужчин в возрасте 29–69 лет без клинически очевидных серьезных заболеваний, было показано полуторакратное (1,46) увеличение риска смерти при ЧСС ≥ 80 в одну минуту, а оптимальной, с точки зрения прогноза, являлась ЧСС ≤ 59 в одну минуту [9].
Стабильная стенокардия — клиническое проявление ишемии миокарда вследствие несоответствия объема коронарного кровотока (Qкор) метаболическим нуждам миокарда — уровню потребления миокардом кислорода (ПМО2).
Объем коронарного кровотока регулируется тоническим состоянием коронарных сосудов и разницей давления в восходящем отделе аорты и полости левого желудочка, которое соответствует внутримиокардиальному давлению (напряжению).
Кровоснабжение миокарда левого желудочка осуществляется только во время диастолы, в отличие от миокарда правого желудочка (коронарная перфузия осуществляется в систолу и в диастолу), так как внутримиокардиальное напряжение (давление) в миокарде левого желудочка во время систолы равно давлению в полости левого желудочка и в восходящем отделе аорты (при отсутствии патологии со стороны аортального клапана).
На эффективность диастолического кровоснабжения миокарда левого желудочка оказывает и «лузитропный эффект» — зависимость скорости диастолического расслабления миокарда от ЧСС: чем чаще сокращается сердце, тем выше скорость диастолического расслабления миокарда и наоборот.
Лечение ИБС преследует две основные цели: улучшение качества жизни (устранение симптомов стенокардии) и улучшение прогноза (предотвращение ИМ и профилактика внезапной кардиогенной смерти). Урежение ритма сердечной деятельности существенно снижает риск развития сердечно-сосудистых осложнений и смертности. В национальных и международных рекомендациях по лечению стабильной стенокардии постулируется необходимость достижения оптимальной ЧСС, равной 55–60 ударов в минуту [1, 2, 3, 4].
Экспериментальные исследования на собаках с хроническим стенозом левой огибающей артерии и у анестезированных свиней показали, что снижение ЧСС (на фоне различных уровней коронарной гипоперфузии) не только улучшает сократительное состояние миокарда, но и вызывает перераспределение миокардиального кровотока в сторону субэндокардиальных слоев миокарда левого желудочка во время физической нагрузки. Полученные результаты позволили авторам предположить, что «…регионарный внутримиокардиальный кровоток в расчете на одно сердечное сокращение является первичной детерминантой региональной сократимости миокарда во время ишемии» [10, 11].
Программы клинических исследований ряда ведущих научно-исследовательских центров мира, состоящих из одного плацебо-контролируемого исследования с определением эффективной дозы Кораксана и двух сравнительных со стандартной терапией препаратами — Атенолол и Амлодипин, продолжительностью каждого исследования до одного года, включали более 5000 пациентов со стабильной стенокардией. Целью исследования являлась оценка антиишемической и антиангинальной эффективности Кораксана в различных дозах при лечении больных со стабильной стенокардией, а также оценка переносимости лечения в этой группе пациентов.
Во всех группах активного лечения показатель ЧСС, по сравнению с группой плацебо, был достоверно ниже как в покое, так и на пике физической нагрузки. В двойном слепом периоде исследования документировано статистически достоверное (р < 0,001) снижение частоты приступов стенокардии и потребности в приеме нитратов короткого действия на фоне лечения Кораксаном по сравнению с плацебо. Так, в группе пациентов, получавших Кораксан, частота приступов снизилась от 4,14 до 0,95 в неделю, что сопровождалось снижением потребности в приеме нитратов с 2,28 до 0,5 мг в неделю.
В международном многоцентровом двойном слепом рандомизированном исследовании INITIATIV (INternatIonal TrIal of the AnTi-anginal effects of IVabardinE) с участием 939 пациентов с документально подтвержденной стабильной стенокардией было проведено 16-недельное сравнительное изучение терапевтической эффективности Кораксана (7,5 и 10 мг 2 раза в сутки) и Атенолола (100 мг 1 раз в сутки). В данном исследовании оценивались показатели пробы с физической нагрузкой на пике концентрации препарата в плазме крови и в конце интервала дозирования. В группе пациентов с Кораксаном к концу 4-месячного лечения достигнуто большее (практически двукратное) увеличение продолжительности физической нагрузки по сравнению с группой пациентов с Атенололом в расчете на уровень снижения ЧСС, с аналогичной динамикой по частоте болевых приступов [1, 5, 8, 9].
Таким образом, представленные выше данные литературного обзора свидетельствуют о высокой прямой корреляционной связи ЧСС с выраженностью клинических проявлений ИБС и ее осложнений.
Нами, с целью изучения влияния кардиоселективных бета1-адреноблокаторов (Бисогамма) и ингибиторов If-каналов синусового узла (Кораксан), было проведено обследование и лечение 97 пациентов со стабильной стенокардией (Классификация канадского Кардиологического общества) I–IV функциональных классов (ФК) в возрасте от 50 до 70 лет, с фракцией выброса (ФВ) > 50%. В зависимости от программы лечения основного заболевания больные были разбиты на две рандомизированные по возрасту подгруппы: в подгруппе А (32 пациента, средний возраст 63,1 ± 2,4 года) базовым лечением ИБС был Кораксан по 5,0 мг 2–3 раза в сутки (средняя суточная доза по подгруппе — 12,3 ± 2,1 мг), в подгруппе Б (65 больных, средний возраст 61,9 ± 3,1 года) базовое лечение — Бисогамма от 5 до 12,5 мг в сутки (средняя суточная доза по подгруппе составила 9,2 ± 0,4 мг). При наличии удлиненного QT-интервала на ЭКГ, к базовой терапии был добавлен Магнерот 3 г в сутки с целью компенсации дефицита магния. Всем больным проводилась антиагрегантная терапия Кардиомагнилом из расчета 75–100 мг/сутки, купирование ангинозных приступов — нитратами короткого действия (нитроглицерин под язык). Длительность лечения больных стабильной стенокардией до контрольного обследования колебалась от четырех до пяти недель.
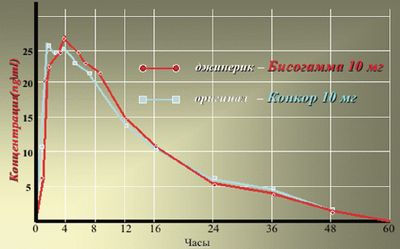
Бисогамма — дженерик оригинального препарата (Бисопролол) — высокоселективный бета1-адреноблокатор, не обладающий внутренней симпатомиметической активностью и мембраностабилизирующим эффектом, с длительным периодом полувыведения (10–12 ч). В терапевтически рекомендуемых дозах (от 2,5 до 10 мг) препарат почти не проявляет антагонистической активности в отношении бета2-адренорецепторов и поэтому не вызывает таких метаболических эффектов, как гипергликемия, дислипидемия или гипокалиемия, не оказывает ангиоспастического влияния на артерии, не вызывает бронхоспазм. По биоэквивалентности Бисогамма практически равна оригинальному препарату Бисопрололу (рис. 1).
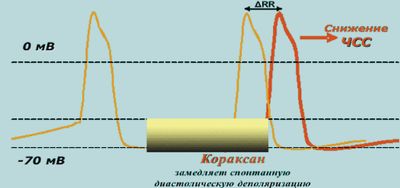
Кораксан (ивабрадин) (Coraxan (Ivabradin)) специфично-селективно блокирует If-каналы ионного К/Na-тока, которые контролируют спонтанную диастолическую деполяризацию в клетках синусового узла (удлиняют время диастолической реполяризации) и регулируют частоту сердечных сокращений (СС), при этом процессы реполяризации желудочков остаются без изменений, что исключает влияние на сократительную (инотропную) функцию миокарда (рис. 2).
C целью выявления частоты ишемических приступов больным, включенным в программу исследования, проводилось суточное мониторирование ЭКГ и артериального давления (АД) на бифункциональном мониторе Card(X)plore (Венгрия).
Функциональный класс стенокардии определяли с помощью нагрузочного теста — количество метров, пройденных за шесть минут без «дискомфорта в области сердца» под контролем ЭКГ-мониторирования.
Для объективизации диастолической функции левого желудочка и глобальной насосной деятельности сердца всем больным проводилось Доплер-ЭхоКГ-обследование. Исследования проводились на аппарате Vivid 3, датчиком с частотой генерируемых сигналов 7,5 МГц с последующим расчетом параметров производительности сердца-насоса (МО л/мин, СИ (сердечный индекс) л/мин/м2, УО мл, ФВ %) и функционального состояния диастолы левого желудочка (Е м/сек — скорость раннего диастолического расслабления, А м/сек — скорость позднего диастолического расслабления, ДТ мсек — время замедления потока крови в диастолу до систолы предсердия, IVRT мсек — время изоволюметрического расслабления левого желудочка.
В табл. 1 представлено количественное распределение 97 больных стабильной стенокардией, включенных в программу исследования, в зависимости от диапазона исходной ЧСС в покое: ЧСС < 70; 70 ≤ ЧСС < 100; ЧСС ≥ 100 сокращений в одну минуту.
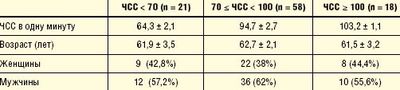
Как видно из таблицы, ЧСС — независимый параметр насосной деятельности сердца от возраста и пола, что подтверждается данными многофакторного корреляционного анализа: r (для всех исследуемых параметров) < 0,2, при p > 0,05.
В табл. 2 представлено распределение ФК стабильной стенокардии в зависимости от пола, ЧСС и толерантности к физической нагрузке среди 97 больных, включенных в исследование.
При корреляционном анализе параметров, представленных в табл. 2, выявлена достоверная, тесная корреляционная связь между ЧСС, степенью ФК стабильной стенокардии и уровнем толерантности к физической нагрузке: rчсс-фк = 0,82 (р < 0,001), за счет снижения хронотропного резерва, что документируется снижением уровня толерантности к физической нагрузке при увеличении исходной ЧСС в покое (отрицательная корреляционная связь) — rчсс-метры = –0,87 (р < 0,001).
ИМ в анамнезе имел место у 29 больных стабильной стенокардией (30%) и в основном был у больных ИБС, у которых ЧСС в покое превышала 70 сокращений в одну минуту, — 27 пациентов (93,1%).
При оценке электрофизиологических параметров по стандартной ЭКГ длительность измеренного QT-интервала, превышающая расчетную величину QT-интервала в зависимости от ЧСС и пола более чем 0,02 сек, расценивалась как патологическая, соответствующая «дефициту магния». В целом по группе отношение QTизм к QTдолж превышало 1,1 в 37,1% случаев (36 пациентов), а частота встречаемости этого показателя в процентном отношении имела линейную зависимость от исходной ЧСС: в покое в диапазоне ЧСС < 70 в одну минуту QTизм/QTдолж > 1,1 было выявлено в пяти случаях из 21 (23,8%), в диапазоне 70 ≤ ЧСС < 100 — 22 пациента из 58 (37,9%), в диапазоне ЧСС ≥ 100 — у 9 больных из 18 (50%).
Результаты распределения длительности QT-интервала в зависимости от диапазона исходной ЧСС в покое представлены в табл. 3.
Результаты ультразвукового обследования больных до и после лечения представлены в табл. 4.
В нашем исследовании у больных стабильной стенокардией на фоне высокой ЧСС (89,7 ± 6,8 в минуту) имели место нарушения диастолы левого желудочка, документируемые снижением скоростей диастолических потоков крови. Скорость раннего диастолического расслабления — Е (0,57 ± 0,09 м/сек) снижена на 8,1%, скорость позднего диастолического расслабления — А (0,47 ± 0,06 м/сек) на 20,5% по отношению к аналогичным возрастным нормативным показателям (NЕ — 0,62 ± 0,14 м/сек, NА — 0,59 ± 0,14 м/сек).
После проведенного лечения увеличение толерантности к физической нагрузке в целом по группе на 36,4% документировалось увеличением количества метров, пройденных за 6 минут (от 302,2 ± 31,4 м/6 мин до 412,1 ± 31,1 м/6 мин, р < 0,001) и статистически достоверным снижением числа ишемических эпизодов (практически вдвое) на 59,1% (от 9,3 ± 0,9 до 3,8 ± 0,5 в сутки, р < 0,001), регистрируемых при холтеровском мониторировании ЭКГ до лечения и при выписке больных из стационара. В подгруппе А частота ишемических эпизодов снизилась на 54,9% (от 9,1 ± 0,7 до 4,1 ± 0,8 в сутки, р < 0,001), в подгруппе Б — на 63,6% (9,5 ± 0,8 до 3,46 ± 0,2 в сутки, р < 0,001), что суммарно привело к снижению потребности в короткодействующих нитратах на две трети.
Подобная положительная клиническая динамика при лечении стабильной стенокардии произошла на фоне улучшения показателей диастолической функции левого желудочка (табл. 4). Как видно из таблицы, параметры насосной деятельности сердца в покое до и после лечения оставались практически (статистически не достоверно) неизменными, на фоне статистически достоверного снижения частоты ритма сердечной деятельности в целом по группе на 29% (p < 0,001). Урежение ритма сердечной деятельности сопровождается увеличением времени диастолы и эффективного коронарного кровоснабжения миокарда левого желудочка, что обеспечило снижение частоты ишемических эпизодов на 54,9%.
К концу лечения скорость раннего диастолического расслабления (Е м/сек) в целом по группе возросла на 61,9% (от 0,43 ± 0,06 м/сек до 0,696 ± 0,06 м/сек, р < 0,01); скорость позднего диастолического расслабления (А м/сек), которая соответствует времени систолы предсердия, также возросла в целом по группе на 44,4% (от 0,475 ± 0,08 м/сек до 0,686 ± 0,07 м/сек, р < 0,001). Отмечено статистически достоверное уменьшение времени замедления диастолического тока крови (ДТ мсек) на 22,1% (от 209,8 ± 15,6 мсек до 163,4 ± 13,7 мсек, p < 0,05).
Диастолическое расслабление, которое контролируется Са-насосом саркоплазматического ретикулума (СПР) кардиомиоцита, энергоемкий процесс, в условиях патологии (ишемия) потребляет до 50% макрофосфатной энергии (АТФ), синтезируемой в митохондриях окислительным фосфорилированием с участием кислорода, доставляемого коронарным кровотоком в диастолу. При дефиците энергии у больных ИБС в первую очередь нарушается диастолическая функция миокарда левого желудочка, развивается диастолическая контрактура — «незавершенная» диастола. «Незавершенная» диастола сопряжена с повышенным внутримиокардиальным напряжением, лимитирующим коронарный кровоток, доставку кислорода на уровне микроциркуляции, особенно к субэндокардиальным слоям миокарда левого желудочка, что клинически манифестируется снижением хронотропного резерва и учащением стенокардитических приступов.
Время IVRT в целом по группе уменьшилось на 12,7% (от 103 ± 7,1 мсек до 89,9 ± 4,1 мсек, р < 0,01). Укорочение IVRT также способствует увеличению времени эффективного коронарного кровотока в диастолу к миокарду левого желудочка. При сопоставлении показатели трансмитрального диастолического потока крови по подгруппам имели схожую положительную динамику по увеличению эффективной длительности диастолического наполнения левого желудочка, что косвенно указывает на отсутствие какого-либо специфического фармакологического лузитропного эффекта Кораксана и Бисогаммы на диастолическую функцию левого желудочка.
Урежение ЧСС в покое на 29% (увеличение хронотропного резерва) сопровождалось восстановлением диастолы с увеличением скоростей раннего (на 61,9%) и позднего (на 44,4%) расслабления миокарда левого желудочка, увеличением толерантности к физической нагрузке на 57,3% и уменьшением частоты стенокардитических приступов на 59,1%.
Таким образом, суммируя вышеизложенное, ЧСС, определяя длительность диастолы, обеспечивающей объем коронарного кровотока к миокарду левого желудочка, является независимым (от пола, возраста, сопутствующих патологий) фактором риска развития сердечно-сосудистых осложнений, прогностическим маркером для качества и прогноза жизни больных стабильной стенокардией.
ЧСС оказывает существенное влияние на состояние диастолической функции миокарда, которая предшествует систоле левого желудочка. Признаки диастолической дисфункции левого желудочка (по данным Доплер-ЭхоКГ-исследования) регистрируются в 86,6% случаев среди больных стабильной стенокардией при ЧСС, в покое превышающей 70 сокращений в одну минуту.
Увеличение ЧСС — снижение тахитропного резерва сопровождается уменьшением толерантности к физической нагрузке и утяжелением ФК стабильной стенокардии, что подтверждается наличием тесной корреляционной связи: r чсс-фк = 0,82 (р < 0,001), r чсс-метры = –0,87 (р < 0,001).
Фармакологическое урежение ЧСС на 29% способствует увеличению толерантности к физической нагрузке на 57,3%, с уменьшением частоты ишемических приступов на 51% и снижением в потребности приема нитратов короткого действия на две трети.
Антиишемический эффект Кораксана (блокатор If-каналов) определяется только его брадикардизирующим эффектом на ЧСС, антишемический эффект Бисогаммы (кардиоселективный бета-блокатор) определяется суммарным снижением ПМО2 за счет уменьшения ЧСС и сократительного состояния миокарда. Добавление препаратов магния в программу лечения стабильной стенокардии способствует нормализации длительности QT-интервала стандартной ЭКГ.
Таким образом, длительность и функциональное состояние диастолы оказывают прямое влияние на баланс между ПМО2 и объемом коронарного кровотока — уровень доставки О2 миокарду левого желудочка, увеличение которой является одним из ведущих патогенетический обоснованных факторов, определяющих антиишемический эффект при лечении ИБС. Увеличение «хронотропного резерва» сердца при назначении кардиоселективных бета1-адреноблокаторов (Бисогамма 5–15 мг в сутки) или ингибиторов If-каналов синусового узла (Кораксан 10–15 мг в сутки) — ведущая детерминанта в обеспечении антиангинального эффекта и увеличения толерантности к физической нагрузке у пациентов со стабильной стенокардией.
Литература
-
Маколкин В. И., Зябрев Ф. Н. Значение частоты сердечных сокращений в практике врача. 2008. 1, 28.
-
Оганов Р. Г. Развитие профилактической кардиологии в России // Кардиоваскулярная терапия и профилактика. 2004. 3 (3), ч. 1, 10–14.
-
Основные положения рекомендаций Европейского общества кардиологов по ведению больных стабильной стенокардией (2006). Эффективная фармакотерапия в кардиологии и ангиологии. 2007. № 2, 1–9.
-
Шальнова С. В., Деев А. Д., Оганов Р. Г. и др. Частота пульса и смертность от сердечно-сосудистых заболеваний у российских мужчин и женщин. Результаты эпидемиологического исследования // Кардиология. 2005. № 10, 45–50.
-
Boraso A. Why is reduced heart rate beneficial // Dialogues in Cardiovascular Medicine. 2001, 6, 19–24.
-
Casstelli W. P., Levy D., Wilson P. W. F. and all. Sudden death: The view from Framingham. The Prevention of Sudden Death. New York. 1990, 1–8.
-
Dyer A., Perski J., Stamler J. and all. Heart rate as prognostic factor for coronary heart disease and mortality: Findings in three Chicago epidemiologic studies // Am. J. Epidemiol. 1980. 12, 736–749.
-
Gillum R. F., Makuc D. M., Feldman J. J. and all. Pulse rate, coronary heart disease and death: NHANES I epidemiologic follow-up study // Am. Heart J. 1991. 121, 172–177.
-
Janssen I., Katzmarzyk P., Church T. S. and all. The Cooper Clinic Mortality Risk Index. Clinical Score Sheet for Men // Am. J. Prev. Med. 2005. 29, 194–203.
-
Levin H. J. Heart rate and life expectancy //J. Amer. Coll. Card. 1997. 30, 1104.
-
Schmidt-Nielsen K. Animal Phisiology: Adaptation and Environment. New York: Cambridge University Press. 1975.
А. М. Шилов, доктор медицинских наук, профессор
А. О. Осия
О. Ф. Тарасенко
ММА им. И. М. Сеченова, Москва
Распределение больных стабильной стенокардией в целом по группе в зависимости от ФК и пола
Результаты измерения QT-интервала величины QT изм/QTдолж в зависимости от исходной ЧСС
Показатели Доплер-ЭхоКГ-исследования до и после лечения больных стабильной стенокардией I–IV ФК
Купить номер с этой статьей в pdf









