Сахарный диабет 1 типа (СД 1) представляет собой важную медико-социальную проблему и остается одним из распространенных эндокринных заболеваний, развивающихся в препубертатном и пубертатном периодах [2, 3, 12]. Наряду со специфическими клиническими проявлениями, СД 1 часто обусловливает нарушения полового и физического развития [5, 9, 10, 13]. Однако представления о роли СД в становлении половой функции у подростков неоднозначны: некоторые авторы утверждают, что возраст, в котором начался диабет у ребенка, не имеет решающего значения, когда речь идет о своевременности и характере полового созревания [5], другие отмечают роль длительности заболевания и степени тяжести диабета как ведущих факторов в развитии нарушений полового созревания у детей, больных СД [3, 9, 12].

Изучая состояние гонадотропной функции гипофиза у больных СД 1, некоторые авторы отметили связь нарушений половой функции с изменением секреции гонадотропинов [5, 9, 10, 11], однако имеются сообщения как о нормальном, так и о сниженном базальном уровне гонадотропинов при СД 1 [5].
У больных СД 1 формируется универсальный спектр тканевых, органных и особенно сосудистых нарушений; механизмы, отвечающие за их развитие, до конца не известны, но установлено, что немаловажную роль здесь играют процессы свободнорадикального окисления (СРО) липидов [4, 6, 7]. Хотя актуальность изучения процессов СРО липидов и состояния антиоксидантной защиты (АОЗ) при СД несомненна, недостаточно освещено состояние этих процессов у детей и подростков при нарушении полового развития и овариально-менструальной функции.
Таким образом, наличие устойчивой тенденции к росту заболеваемости СД 1 у детей и подростков в сочетании с патологическими изменениями в репродуктивной системе является основанием для проведения исследований, направленных на уточнение патогенетических механизмов репродуктивных нарушений, выявление условий наиболее неблагоприятного развития и течения этих процессов, определение иерархии и значимости факторов различной природы, оказывающих негативное воздействие на половое и физическое развитие девочек и девушек, больных СД 1.
Целью нашего исследования стало выявление основных закономерностей и факторов риска формирования нарушений полового, физического развития и менструальной функции девочек и девушек, больных сахарным диабетом 1 типа.
Были обследованы 58 девочек и девушек, больных СД 1. Средний возраст пациенток составил 15,2 + 2,8 лет. В фазе компенсации наблюдали 6 человек (10%), субкомпенсации — 13 (22%), декомпенсации — 39 (68%). Длительность заболевания составляла от 1 года до 15 лет. Средняя продолжительность течения СД составила 5,1 ± 3,5 лет.
Группа сравнения была сформирована по типу «копия-пара», т. е. каждый член сравниваемой группы имел совпадающие или близкие по значению изучаемые параметры, таким образом, группу сравнения составили 58 девочек и девушек, отличающихся от опытной группы только отсутствием диабета.
Больных СД мы разделили на 3 группы: 1-я — 16 человек (27,6%) с нормальным физическим развитием, 2-я — 21 человек (36,2%) с пограничными нарушениями в половом и физическом развитии и 3-я группа — 21 пациентка (36,2%) с выраженным отставанием в половом и физическом развитии.
В качестве материала для биохимического исследования использовалась сыворотка крови. Определение концентрации ПРЛ, ТТГ, ЛГ, ФСГ, Т4 проводилось с помощью радиоиммунологических наборов «Диас» (Россия) с использованием анализатора «Бета-2»; уровень содержания Т3 оценивали иммуноферментным методом с использованием тест-систем «АЛКОР-БИО» (Россия) и анализатора EL 808 (США). Забор крови для гормональных исследований осуществлялся с учетом фаз менструального цикла (на 5–9-й день цикла) или на фоне аменореи в утренние часы, натощак.
Исследовали концентрации продуктов СРО липидов и системы АОЗ: диеновые конъюгаты (ДК), малоновый диальдегид (МДА), активность супероксиддисмутазы (СОД), ретинол и α-токоферол флуориметрическим методом. (В качестве внешнего стандарта использовался D, L, α-токоферол фирмы «Serva».) Определение восстановленного глутатиона (GSH), окисленного глутатиона (GSSG) производили на спектрофлюорофотометре (RT-5000) Shimadzu. Гликозилированный гемоглобин (Hb A1) определяли с использованием ионообменного метода.
В результате проведенного нами исследования факторов риска развития нарушений полового, физического развития и менструальной функции у больных СД 1 оказалось, что особое значение имеет возраст дебюта заболевания СД, а именно препубертатный период (7–11 лет). При этом половое созревание у больных с манифестацией СД именно в этот период значительно отстает по сравнению со сверстницами, дебют заболевания у которых пришелся на ранний период (3–7 лет), на пубертатный период (11–14 лет) или постпубертатный период (старше 14 лет). Доля больных с выраженной задержкой полового и физического развития с дебютом СД 1 в препубертатном периоде составляет 61,9%, в раннем периоде — 14,3%, в активном пубертатном периоде — 14,3% и в постпубертатном периоде — 9,5% (рис. 1).
Половое развитие у девочек в возрасте 10–13 лет и манифестацией СД в период 7–11 лет значимо отставало в сравнении с девочками, дебют заболевания у которых пришелся на ранний период (от 3 до 7 лет). Значительно запаздывало половое развитие у девочек и девушек в возрасте 14–17 лет с манифестацией СД в период от 7 до 11 лет по сравнению с больными, у которых манифестация СД имела место до 7-летнего возраста. У девушек 18–21 года с дебютом СД в возрасте 7–11 лет регистрировались значительно более низкие показатели полового развития по сравнению с другими возрастными периодами манифестации заболевания (рис. 2).
 |
| Рисунок 2. Половое развитие у больных СД 1 в зависимости от сроков манифестации по возрастам |
У девушек с СД 1, имеющих регулярный менструальный цикл и соответствующее возрасту половое и физическое развитие (1-я группа), а также у больных с дисгармоничным развитием и дисфункцией яичников (2-я группа) выявляется тот же уровень концентрации пролактина и фолликулостимулирующего гормона, что и у рандомизированных групп (табл.). У больных СД с выраженной задержкой полового и физического развития (3-я группа) содержание в плазме крови пролактина и ФСГ значительно снижено по сравнению с лицами из рандомизированных групп. Средние концентрации ФСГ и пролактина у больных 3-й группы были значительно снижены по сравнению с таковыми во 2-й группе. Кроме того, мы обнаружили значительное снижение среднего уровня ЛГ у больных с СД 1 независимо от их возраста, полового и физического развития и характера нарушений овариально-менструальной функции в сравнении с девочками и девушками, охваченными рандомизацией.
Наиболее выраженные изменения интенсивности СРО липидов мы отмечали у пациенток из 3-й группы: концентрация гидроперекисей и конечных продуктов СРО липидов (МДА и ДК) была увеличена по сравнению с группой сравнения. Одновременно мы обнаружили значимое снижение концентраций восстановленного и окисленного глутатиона у больных СД 3-й группы по сравнению с лицами из рандомизированных групп (соответственно на 25,4 и 24%), а также снижение уровня α-токоферола и ретинола (соответственно на 36 и 28,3%). У девочек и девушек 3-й группы было отмечено значительное снижение активности GSH, концентраций a-токоферола и ретинола по сравнению с показателями больных, имеющих нормальное развитие. Нами не было выявлено значительных изменений активности СОД и антиокислительной активности крови у больных СД 1 в зависимости от выраженности нарушений полового и физического развития.
На основании полученных результатов нами была предложена концептуальная схема, отражающая факторы риска и основные механизмы формирования нарушений полового и физического развития у девочек и девушек с СД 1 (рис.3).
В заключение следует отметить, что ранняя диагностика и прогнозирование нарушений полового развития и менструальной функции у девочек и девушек, больных СД 1, позволят своевременно начинать проведение комплексной патогенетической терапии, включая коррекцию овариальных нарушений, что необходимо для сохранения у данной категории женщин способности к деторождению.
Литература
- Баранов А. Н. Репродуктивное здоровье девочек и девушек — жительниц Европейского севера // Экология человека. — 1999. — № 4. — С. 25–26.
- Дедов И. И. Сахарный диабет — проблема 21 века // Врач. — 2000. — №1. — С. 4–5.
- Дедов И. И., Мельниченко Г. А., Бердыклычева А. А. Фертильность женщин, страдающих ИЗСД // Проблемы эндокринологии. —1995. — №2. — С. 8–11.
- 4. Лейфер А. И., Солун М. Н. Система перекисное окисление липидов — антиоксидантная защита и роль ее нарушений в патогенезе сахарного диабета и ангиопатий // Проблемы эндокринологии. — 1993. — Т.39. — № 1. — С. 57–60.
- 5. Матвеева Л. С., Бердыклычева А. А. Стекольщикова О. Д. Репродуктивная функция у женщин с ИЗСД // Проблемы эндокринологии. — 1994. — № 40. — С. 52–56.
- Нелаева А. А., Башевский А. Ш., Трошина И. А., Журавлева Т. Г. Перекисное окисление липидов у больных инсулинзависимым сахарным диабетом // Проблемы эндокринологии.-1998. — №5. — С. 10–14.
- Никифоров О. Н., Сазонова О. В., Суханова Л. Я., Князькова Л. Г. Перекисное окисление липидов и состояние антиоксидантной защиты у больных с инсулинзависимым сахарным диабетом // Проблемы эндокринологии. — 1997. — №5. — С. 16-19.
- Сметанин В. Н., Швачкина В. И. К характеристике репродуктивного здоровья городских девочек-подростков // Здравоохранение Российской Федерации. — 2001. — № 1. — С. 31-33.
- Стекольщикова О. Д. Нарушение и возможные пути коррекции репродуктивной системы у пациенток с ИЗСД//Проблемы репрод. — 1997. — № 2. С. 15-20.
- Adcock C. J., Adcock C. J., Perry L. A., Lindsell D. R. Menstrual irregularities are more common in adolescents with type 1 diabetes: association with poor glycamic control and weight gain // Diabet Med.—1994. — Vol.11. — N 5. — P. 465 — 470.
- Djursing H., Andersen A., Hagen C. et al. Gonadotropin secretion before and during acute and chronic dopamine receptor blockade in IDDM patients with amenorrhea //Fertil. Steril. — 1985. — Vol. — 44. — P. 49-55.
- Dunger D. B., Edge J. A. Diabetes and the endocrine changes of puberty // Practical Diabetes International. — 1995. — Vol. 12. — P. 63-66.
- Yeshaya A., Orvoero R., Dicker D., Karp M. Menstrual characteristics of women suffering from IDDM // Int . J. Fertil. — 1995. — Vol. 40. — № 5. — P. 269-273.
О. Я. Лещенко
Клиника Института педиатрии и репродукции человека Научного центра медицинской экологии ВСНЦ СО РАМН, Иркутск
Приложения
-
- Сахарный диабет и репродуктивная система девочек-подростков - Рисунок 1.
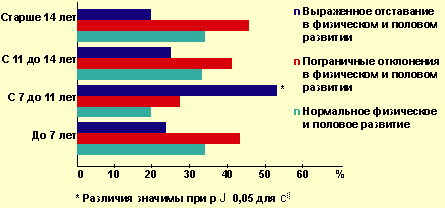
Показатели распространенности нарушений полового и физического развития у девочек в зависимости от сроков манифестации СД (в %)
-
- Сахарный диабет и репродуктивная система девочек-подростков - Рисунок 3.
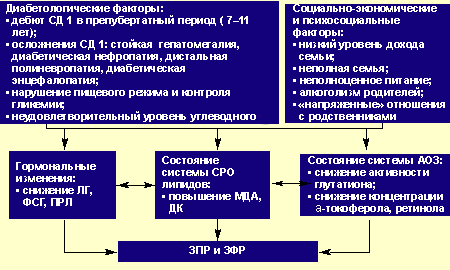
Основные механизмы и факторы риска формирования задержки полового (ЗПР) и физического развития (ЗФР) у девочек и девушек при СД 1
-
- Сахарный диабет и репродуктивная система девочек-подростков - Таблица
Сравнительная характеристика уровня гонадотропинов у больных СД и в группе сравнения
Показатель Нормальное физическое и половое развитие (n = 16, средний возраст - 14,0 + 1,7) Пограничные отклонения в физическом и половом развитии (n = 21, средний возраст - 16,0 + 1,9) Выраженное отставание в физическом и половом развитии (n = 21, средний возраст - 15,0 + 0,9) ЛГ (МЕ/мл) Больные 2,7 ± 0,3*
4,2 ± 0,5*2,4 ± 0,5*
5,6 ± 1,1*2,0 ± 0,2*
4,3 ± 0,4*Группа сравнения ФСГ (МЕ/мл) Больные 4,3 ± 0,8
6,5 ± 1,25,2 ± 0,9
6,7 ± 1,13,6 ± 0,2*
6,6 ± 0,9Группа сравнения ПРЛ (МЕ/мл) Больные 159,8 ± 36,8
218,6 ± 36,6236,3 ± 42,5
249,2 ± 45,5139,9 ± 29,3*
319,9 ± 67,7Группа сравнения *Различия значимы при р ≤0,05.









