Стридор — это грубый различного тона звук, вызванный турбулентным воздушным потоком при прохождении через суженный участок дыхательных путей [36]. Стридор у новорожденных и грудных детей — это патология, которая является симптомом дыхательной обструкции [7]. Стридор может быть симптомом угрожающих жизни заболеваний. Наиболее важными характеристиками стридора являются его громкость, высота и фаза дыхания, на которой он появляется.
Громкий стридор обычно является симптомом выраженного сужения дыхательных путей. В случае прогрессивно усиливающегося стридора внезапно ослабевший звук может быть признаком усилившейся обструкции, ослабления дыхательных движений и возникновения коллапса дыхательных путей [28].
Высоко звучащий стридор обычно вызван обструкцией на уровне голосовых складок [26], низко — патологией выше голосовых складок (гортанная часть глотки, верхний отдел гортани). Стридор средней высоты чаще является симптомом обструкции ниже голосовых складок [41].
Наиболее важным признаком, позволяющим заподозрить уровень поражения, является фаза дыхания, на которой стридор слышен лучше всего. По этому признаку стридор может быть разделен на три типа: инспираторный, экспираторный и двухфазный. Инспираторный стридор обычно вызывается поражением, локализующимся выше голосовых складок, и продуцируется коллапсом мягких тканей при отрицательном давлении во время вдоха [22]. Двухфазный стридор обычно высокий по тону. Он вызван поражением на уровне голосовых складок или подскладкового отдела [16, 18]. Экспираторный стридор чаще возникает при поражении нижних отделов дыхательных путей [42].
Анамнез очень важен для диагностики заболевания. Ключевыми анамнестическими данными являются причины и длительность интубации (если она ранее производилась) в неонатальный период. Другие анамнестические признаки включают возраст на момент появления стридора, длительность стридора, ассоциацию с плачем или кормлением, с положением ребенка; наличие других сопутствующих симптомов, таких как пароксизмы кашля, аспирация или срыгивание [40, 41].
При осмотре ребенка следует оценить его общее состояние, частоту дыхательных движений и сердечных сокращений, цвет кожи. Кроме того, следует обратить внимание на возможные аномалии строения головы, участие дополнительных мышц в акте дыхания, втяжение уступчивых мест грудной клетки и другие признаки, исключить возможное инфекционное заболевание [36].
При состоянии ребенка, не требующем немедленного вмешательства, следует произвести рентгенографию гортани и мягких тканей шеи в передней и боковой проекции, грудной клетки, а также рентгеноскопию пищевода с водорастворимым рентгеноконтрастным веществом. Кроме того, могут быть полезны ультразвуковое исследование гортани, компьютерная томография, ядерно-магнитный резонанс [12, 30].
Наиболее информативным методом диагностики заболевания, проявляющегося врожденным стридором, является эндоскопическое исследование: фиброскопия; прямая ларингоскопия под наркозом, желательно — с использованием микроскопа; трахеобронхо- и эзофагоскопия [11, 36]. При этом необходимо учитывать возможность аномального строения нескольких отделов дыхательных путей [23, 25].
- Наиболее частые причины, вызывающие стридор у новорожденных и детей грудного возраста
 |
| Рисунок 1. Эндофотография гортани. Мягкий, западающий в просвет дыхательных путей надгортанник |
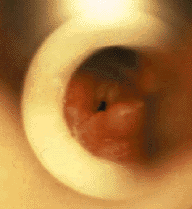 |
| Рисунок 2. Эндофотография гортани. Западающие в просвет гортани черпаловидные хрящи |
Паралич голосовых складок — вторая по частоте причина врожденного стридора [39, 41]. Обычно его обнаруживают у детей с другими врожденными аномалиями или с поражением ЦНС [29]. Часто причина паралича остается невыясненной, и такой вид паралича считается идиопатическим. В случае идиопатического паралича (возможной причиной которого является родовая травма) часто
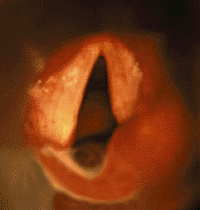 |
| Рисунок 3. Эндофотография гортани. Паралич правой черпаловидной складки |
Двусторонний паралич вызывает высокотональный стридор и афонию. Около половины детей с двусторонним параличем нуждаются в трахеотомии [22, 26, 39].
При одностороннем параличе (рис. 3) обычно отмечают слабый крик, голос с возрастом постепенно улучшается. Дыхательная функция при одностороннем параличе обычно не страдает [28].
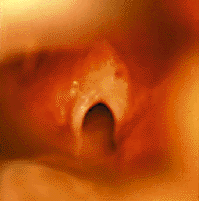 |
| Рисунок 4. Эндофотография гортани. Врожденная рубцовая мембрана гортани |
Врожденные рубцовая мембрана (рис. 4) и подскладковый стеноз развиваются в результате неполного разделения зародышевой мезенхимы между двумя стенками формирующейся гортани [33]. Значительно чаще обнаруживают приобретенные рубцовые стенозы (рис. 5), обычно развивающиеся в результате продленной чрезгортанной назотрахеальной интубации. Тяжесть заболевания зависит от степени поражения: небольшая рубцовая мембрана, локализующаяся только в области передней комиссуры, клинически проявляется лишь изменением голоса («петушиный крик»); полная атрезия гортани совместима с жизнью только теоретически [30].
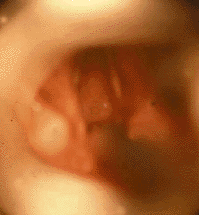 |
| Рисунок 5. Эндофотография гортани. Приобретенный подскладковый стеноз (точечный просвет дыхательных путей) |
Ведущими клиническими симптомами заболевания являются явления обструкции верхних дыхательных путей, такие как двухфазный стридор, тахипноэ, цианоз, беспокойство, раздувание крыльев носа при дыхании, участие в акте дыхания вспомогательной мускулатуры и др. При локализации мембраны в области голосовых складок отмечаются нарушения голоса вплоть до афонии.
Ведущий метод диагностики — эндоскопия [30], хотя косвенно помогает рентгенография гортани и трахеи в передней и боковой проекции.
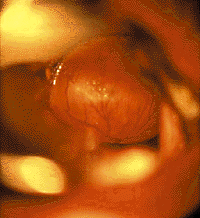 |
| Рисунок 6. Эндофотография гортани. Киста язычной поверхности надгортанника |
Лечение обусловлено выраженностью симптомов. Только дети с небольшой переднекомиссуральной синехией могут быть оставлены под наблюдением без оперативного лечения; больные с мембраной средних размеров, вызывающей нарушение дыхания, требуют оперативного лечения (чаще — лазерная деструкция) в период новорожденности. Дети с выраженной мембраной обычно нуждаются в трахеотомии в период новорожденности с последующей операцией (при помощи лазера или наружным доступом) в более старшем возрасте [17, 38].
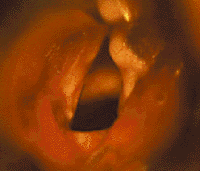 |
| Рисунок 7. Эндофотография гортани. Киста правой голосовой складки |
В ряде случаев врожденный подскладковый стеноз сопровождается другими врожденными поражениями [34]. При выборе тактики лечения необходимо учитывать, что дыхание может улучшаться с ростом гортани.
Кисты гортани. Стридор возникает при росте кисты в просвет дыхательных путей или сдавлении мягких тканей гортани. Кроме того, при локализации на гортанной и особенно на язычной поверхности надгортанника (рис. 6) они могут вызывать дисфагические явления [20, 30].
Локализация кист может быть разнообразной — надгортанник, надскладковая область, черпалонадгортанные складки, подскладковый отдел. Часто кисты развиваются у детей с интубацией в анамнезе, и в таких случаях могут быть множественными. Небольшие кисты голосовых складок (рис. 7) клинически проявляются только охриплостью. При зеркальной ларингоскопии, особенно если подслизистая киста локализуется на границе передней и средней трети голосовой складки, ее ошибочно диагностируют как «певческий» узелок. В этом случае правильный диагноз можно установить только при осмотре гортани под наркозом с применением оптики.
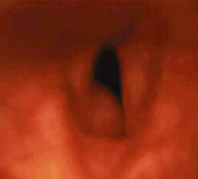 |
| Рисунок 8. Эндофотография гортани. Подскладковая гемангиома под левой голосовой складкой |
Для лечения используют аспирацию содержимого кисты с последующим иссечением ее стенок микроинструментами или СО2-лазером [6, 8, 30].
Кисты часто рецидивируют. В некоторых случаях требуются операции наружным доступом для иссечения больших множественных рецидивирующих кист [31].
Подскладковая гемангиома (рис. 8) угрожает жизни ребенка. По данным зарубежной литературы, средняя летальность от этого заболевания составляет 8,5% [43]. В большинстве случаев подскладковая гемангиома имеется с рождения и подвергается росту в течение первых месяцев жизни. Стридор обычно появляется на 2-3 месяце жизни, первые симптомы заболевания обычно ошибочно диагностируют как круп [27]. В трех наших наблюдениях дыхательный стеноз развился в первые сутки после криодеструкции гемангиом кожи. Стридор обычно двухфазный, голос может быть не изменен. Более половины детей имеют гемангиомы кожи. Как и при гемангиомах кожи, девочки страдают втрое чаще мальчиков [9]. Тяжесть заболевания зависит от размера гемангиомы, в случае присоединения ОРВИ или при беспокойстве дыхание может ухудшаться.
Ведущий метод диагностики — эндоскопия. Обычно обнаруживают мягкотканное выбухание розового или красного цвета под голосовой складкой (чаще — под левой) [5]. Если ребенок был ранее интубирован в связи с дыхательным стенозом, гемангиома может быть не диагностирована при осмотре дыхательных путей сразу после экстубации.
Для лечения используется СО2-лазерная деструкция гемангиомы с последующей гормональной терапией [6, 24]. В случае прорастания в гортань гемангиомы передней поверхности шеи необходима трахеотомия с последующей близкофокусной рентгенотерапией или лечением кортикостероидами [2].
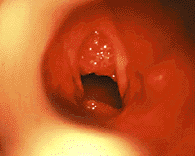 |
| Рисунок 9. Эндофотография гортани. Ювенильный респираторный папилломатоз |
Ювенильный респираторный папилломатоз (ЮРП) (рис. 9) — наиболее часто встречающаяся опухоль верхних дыхательных путей у детей. Этиологическим фактором папилломатоза является вирус папилломы человека, чаще — 6 и 11 типа [3]. Хотя у подавляющего большинства больных первые симптомы заболевания развиваются на 2 — 3 году жизни, в ряде случаев можно говорить о врожденном папилломатозе гортани, когда первые симптомы заболевания отмечают с момента рождения [1].
Начальным симптомом заболевания обычно является охриплость, постепенно переходящая в афонию. В дальнейшем, по мере роста папиллом и сужения просвета голосовой щели (обтурирующая форма), возникает прогрессирующий стеноз гортани, проявляющийся как инспираторный или двухфазный стридор [10].
Наиболее частой первичной локализацией папиллом гортани является область комиссуры и передней трети голосовых складок. На более поздних этапах заболевания папилломы могут поражать все отделы гортани, а также выходить за ее пределы. Папилломы обычно имеют широкое основание, однако возможен рост конгломератов папиллом на небольшой ножке. По внешнему виду папилломы напоминают тутовую ягоду или кисть винограда. При микроларингоскопии поверхность папиллом обычно неровная мелкозернистая или мелкодольчатая, цвет — чаще бледно-розовый, иногда с сероватым оттенком. Тяжесть заболевания определяется скоростью роста папиллом и частотой рецидивирования [15].
Основным методом ликвидации стеноза у детей с ЮРП является хирургическое удаление папиллом при помощи микроинструментов и/или СО2-лазера. Однако только хирургическое лечение у большинства больных не предотвращает рецидива заболевания. В настоящее время наиболее патогенетически оправданным и перспективным является длительное непрерывное введение препаратов интерферона [13, 19, 21].
Трахеомаляция. Различают диффузную и локальную формы трахеомаляции, т. е. слабости стенки трахеи, связанной с патологической мягкостью ее хрящевого каркаса. Клинически заболевание проявляется экспираторным стридором. При эндоскопии обнаруживают резкое сужение на выдохе просвета трахеи, которая может принимать различную форму. Симптомы заболевания часто спонтанно исчезают на 2 — 3 году жизни [32]. При выраженных дыхательных нарушениях может потребоваться трахеотомия [41].
 |
| Рисунок 10. Эндофотография трахеи. Врожденный рубцовый стеноз |
Врожденный стеноз трахеи (рис. 10) может иметь различную природу. Органические стенозы связаны с локальным дефектом хрящевых полуколец трахеи (недостаток или отсутствие хряща) или избыточным образованием хрящевой ткани, приводящим к формированию твердого хрящевого выпячивания в просвет трахеи [42].
Функциональные стенозы связаны с чрезмерной мягкостью хрящей и в этом случае являются локальной формой трахеомаляции. Экспираторный стридор обнаруживают обычно сразу после рождения. Стридор усиливается при беспокойстве или кормлении ребенка. Состояние больного обычно резко ухудшается во время ОРВИ, в некоторых случаях отмечают приступы удушья, ошибочно диагностируемые как круп. Для исключения сдавливания трахеи извне необходимо рентгеноконтрастное исследование пищевода. Основной способ диагностики — эндоскопический. Стенозы трахеи, особенно на почве трахеомаляции, имеют благоприятный прогноз, в большинстве случаев спонтанно излечиваются.
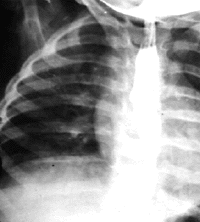 |
| Рисунок 11. Рентгенограмма органов грудной клетки. Сдавление пищевода аномально расположенным сосудом |
При эндоскопии можно обнаружить выбухание и, в ряде случаев, пульсацию передней стенки трахеи. Лечение — хирургическое.
Ларинготрахеопищеводная щель — редкий врожденный дефект развития. На большом протяжении дыхательные пути сообщаются с пищеводом. Причиной этого порока является незаращение дорсальной части перстневидного хряща. Это заболевание клинически проявляется средней громкости двухфазным стридором и эпизодами аспирации. У детей с этим пороком часто отмечают повторные пневмонии. Типичными являются пароксизмы кашля и цианоз. Голос тихий. Приблизительно у 20% детей имеется также трахеопищеводная фистула с характерной локализацией в дистальном отделе трахеи [35]. Для установления диагноза, кроме эндоскопии, требуется рентгеноскопия органов грудной клетки с контрастом. Для лечения необходима не только трахеотомия, но и наложение гастростомы для кормления ребенка.
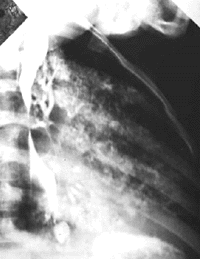 |
| Рисунок 12. Рентгенограмма органов грудной клетки. Затекание рентгеноконтрастного вещества через трахеопищеводный свищ из пищевода в трахеобронхиальное дерево |
Трахеопищеводный свищ (рис. 12) проявляется при первом же кормлении ребенка тяжелыми приступами удушья, кашля и цианоза [41]. В основе порока лежит неполное развитие трахеопищеводной стенки. Часто этот порок сочетается с атрезией пищевода. В дальнейшем быстро присоединяется тяжелая аспирационная пневмония. Лечение только хирургическое, результаты часто зависят от срока операции. Прогноз тем более благоприятен, чем раньше предпринято вмешательство.
- Медико-генетическое консультирование
Учитывая то, что пороки развития гортани и трахеи являются проявлением эмбриопатий, у больных с врожденной патологией этих органов весьма вероятны проявления эмбриопатий со стороны других органов и систем. В клинической практике наибольшую сложность для установления нозологической формы заболевания представляют его синдромальные формы. В основу синдромального метода обследования положено то обстоятельство, что большинство дефектов развития могут быть изолированными или входить в состав известных синдромов или неуточненных комплексов множественных врожденных дефектов. Установление синдромологического диагноза влияет на следующие факторы: 1) проведение тщательной диагностики скрытых дефектов развития и функциональных отклонений в рамках установленного синдрома; 2) выполнение специфической предоперационной подготовки больного для предупреждения возможных осложнений во время хирургического вмешательства или в послеоперационном периоде; 3) тактику и результаты лечения, что выражается в ряде случаев в отказе от хирургических вмешательств, в том числе в изменении хирургической техники коррекции некоторых дефектов развития.
По нашим данным, синдромологический диагноз может быть установлен приблизительно у 25% больных [4]. Лишь у 8-10% детей врожденная патология гортани и трахеи имеет изолированную форму. Остальные больные с врожденными заболеваниями гортани и трахеи имеют иные пороки развития — центральной нервной, костно-мышечной, сердечно-сосудистой систем, аномалии развития ушных раковин, пороки развития лица, аномалии соединительной ткани, врожденные опухолевидные образования кожи и др. Сочетание пороков развития органов нескольких систем, не индуцируемых друг другом, у этой группы больных можно расценивать как множественные неуточненные врожденные пороки развития.
Литература
1. Богомильский М. Р., Солдатский Ю. Л., Маслова И. В., Нурмухаметов Р. Х. Врожденный ювенильный респираторный папилломатоз гортани // Вестник оториноларингологии. 1998. № 6. С. 28 — 29.2. Водолазов С. Ю., Поспелов Н. В. Комбинированное лечение детей с распространенным гемангиоматозом головы, шеи, лица в сочетании с подскладковой гемангиомой гортани. В кн.: Материалы XV Всероссийского съезда оториноларингологов, 25-29.09.1995 г. Том II. СПб, 1995. С. 273 — 275.
3. Герайн В., Чирешкин Д. Г. Молекулярно-биологические аспекты ювенильного респираторного папилломатоза и его комбинированное лечение // Вестник оториноларингологии. 1996. № 4. С. 3 — 8.
4. Маслова И. В., Солониченко В. Г., Солдатский Ю. Л., Онуфриева Е. К. Генетические аспекты врожденной патологии гортани и трахеи // Вестник оториноларингологии. 1999. № 2. С. 30 — 33.
5. Солдатский Ю. Л., Онуфриева Е. К. Подскладковая гемангиома как причина стеноза гортани у детей раннего возраста // Вестник оториноларингологии. 1997. № 6. С. 19 — 21.
6. Солдатский Ю. Л., Маслова И. В., Онуфриева Е. К. Лазерная эндоскопическая хирургия врожденных заболеваний гортани у детей // Лазерная медицина. 1998. Т. 2. № 2 — 3. С. 36 — 38.
7. Солдатский Ю. Л., Онуфриева Е. К., Маслова И. В. Стридор у новорожденных и детей грудного возраста. В кн.: Материалы V Конгресса педиатров России «Здоровый ребенок», 16-18.02.1999. Москва, 1999. С. 430 — 431.
8. Цветков Э. А., Фадеева И. А. Хирургическое лечение врожденных кист гортани // Вестник оториноларингологии. 1999. № 3. С. 42 — 45.
9. Чирешкин Д. Г., Онуфриева Е. К., Солдатский Ю. Л. Сосудистые опухоли гортани, глотки и полости рта у детей // Вестник оториноларингологии. 1994. № 4. С. 29 — 32.
10. Чирешкин Д. Г. Хроническая обструкция гортанной части глотки, гортани и трахеи у детей. М.: Рапид-Принт, 1994. С. 144.
11. Чирешкин Д. Г., Маслова И. В., Онуфриева Е. К., Солдатский Ю. Л. Структура и ранняя симптоматика врожденных заболеваний гортани и трахеи // Вестник оториноларингологии. 1996, № 5. С. 13 — 18.
12. Шантуров А. Г., Субботина М. В. Ультразвуковая диагностика в детской ларингологии. Иркутск: Папирус, 1994. С. 140.
13. Avidano M. A., Singleton G. T. Adjuvant drug strategies in the treatment of reccurent respiratory papillomatosis // Otolaryngology — Head and Neck Surgery. 1995. Vol. 112. P. 197 — 202.
14. Backer C. L., Ilbawi M. N., Idriss F. S. Vascular anomalies causing tracheoesophageal compression // J. Thorac Cardiovasc. Surg. 1989. Vol. 97. P. 725 — 731.
15. Bauman N. M., Smith R. J. Recurrent respiratory papillomatosis // Pediatr. Clin. North. Am. 1996. Vol. 43. P. 1385 — 1401.
16. Belmont J. R., Grundfast K. M. Congenital laryngeal stridor (laryngomalacia): etiologic factors and associated disorders // Ann. Otol. Rhinol. Laryngol. 1984. Vol. 93. P. 430 — 436.
17. Benjamin B., Jacobson I., Eckstein R. Idiopathic subglottic stenoses: diagnosis and endoscopic laser treatment //Ann. Otol. Rhinol. Laryngol. 1997. Vol. 106. P. 770 — 774.
18. Benjamin B., Mair E. A. Congenital interarytenoid web // Arch. Otolaryngol. Head Neck Surg. 1991. Vol. 117. P. 1118 — 1122.
19. Chmielik M., Piekarniak P., Snieg B. Microsurgical treatment of laryngeal papillomatosis // Otolaryngol. Pol. 1997. Vol. 51. P. 26 — 30.
20. Civantos F. J., Holinger L. D. Laryngoceles and saccular cysts in infants and children // Arch. Otolaryngol. Head Neck Surg. 1992. Vol. 118. P. 296 — 300.
21. Deunas L., Alcantud V., Alvarez F. et al. Use of interferon-alpha in laryngeal papillomatosis: eight years of the Cuban national programme // J. Laryngol. Otol. 1997. Vol. 111. P. 134 — 140.
22. Ferguson C. F. Congenital abnormalities of the infant larynx // Ann. Otol. Rhinol. Laryngol. 1967. Vol. 76. P. 744 — 752.
23. Friedman E. M., Vastola A. P., McGill T. J., Healy G. B. Chronic pediatric stridor: etiology and outcome // Laryngoscope. 1990, Vol. 100. P. 277 — 280.
24. Froehlich P., Seid A. B., Morgon A. Contrasting strategic approaches to the management of subglottic hemangiomas // Int. J. Pediatr. Otorhinolaryngol. 1996. Vol. 36. P. 137 — 146.
25. Gonzales C., Reilly J. S., Bluestone C. D. Synchronous airway lessions in infancy // Ann. Otol. Rhinol. Laryngol. 1987. Vol. 96. P. 77 — 80.
26. Grundfast K. M., Harley E. H. Vocal cord paralysis // Otolaryngol. Clin. North. Am. 1989. Vol. 22. P. 569 — 597.
27. Healy G. B., McGill T., Friedman E. M. Carbon Dioxide Laser in Subglottic Hemangioma. An update. // Ann. Otol. Rhinol. Laryngol. 1984. Vol. 93. P. 370 — 373.
28. Holinger L. D. Etiology of stridor in the neonatale, infant and child // Ann. Otol. Rhinol Laryngol. 1980. Vol. 89. P. 397 — 400.
29. Holinger L. D., Holinger P. C., Holinger P. H. Etiology of bilateral abductor vocal cord paralysis: A review of 389 cases // Ann. Otol. Rhinol. Laryngol. 1976. Vol. 85. P. 428 — 436.
30. Holinger L. D., Lusk R. P., Green C. G. Pediatric laryngology and bronchoesophagology. Philadelphia — NY : Lippincott — Raven, 1997. Р. 402.
31. Holinger P. H., Brown W. T. Congenital webs, cysts, laryngoceles and other anomalies of the larynx // Ann. Otol. Rhinol. Laryngol. 1967. Vol. 76. P. 744 — 752.
32. Jacobs I., Welmore R., Tom L. et al. Tracheobronchomalacia in children // Arch. Otolaryngol. Head Neck Surg. 1994, Vol. 120. P. 154 — 158.
33. McGill T. Congenital diseases of the larynx // Otolaryngol. Clin. North. Am. 1984. Vol. 17. P. 57 — 62.
34. Miller R., Gray S. D., Cotton R. T., Myer C. M., Netterville J. Subglottic stenosis and Down syndrome // Am. J. Otolaryngol. 1990. Vol. 11. P. 274 — 277.
35. Myer C. M., Cotton R. T., Holmes D. Laryngeal and laryngotracheoesophageal clefts: The role of early surgical repair // Ann. Otol. Rhinol. Laryngol. 1990. Vol. 99. P. 98 — 104.
36. Nowlin J. H., Zalzal G. The stridorous infant // ENT J. 1989. V. 70. P. 84 — 88.
37. Park S. C. Vascular abnormalites // Pediatr. Clin. North. Am. 1981. Vol. 28. P. 949 — 955.
38. Park S. S., Streitz J. M. Jr., Rebeiz E. E., Shapshay S. M. Idiopathic subglottic stenosis // Arch. Otolaryngol. Head Neck Surg. 1995. Vol. 121. P. 894 — 897.
39. Parnell F. W., Brandenberg J. H. Vocal cord paralysis: A review of 100 cases // Laryngoscope. 1970. Vol. 70. P. 1036 — 1045.
40. Pransky S. M., Grundfast K. M. Differentiating upper from lower airway compromise in neonates // Ann. Otol. Rhinol. Laryngol. 1985. Vol. 94. P. 509 — 515.
41. Richardson M. A., Cotton R.T. Anatomic abnormalities of the pediatric airway // Pediatr. Clinic. North. Am. 1995. Vol. 31. P. 821 — 834.
42. Rimmell F. L., Stool S. E. Diagnosis and management of pediatric tracheal stenosis // Otolaryngol. Clin. North. Am. 1995. Vol. 28. P.809 — 827.
43. Shikhani A. H., Marsh B. R., Jones M. M., Holliday M. J. Infantile subglottic hemangiomas. An update // Ann. Otol. Rhinol. Laryngol. 1986. Vol. 95. P. 336 — 347.
Обратите внимание!
- Стридор у новорожденных является симптомом частичной обструкции дыхательных путей большого диаметра
- Для диагностики заболевания необходим тщательный сбор анамнеза и клиническое обследование ребенка с целью оценки тяжести его состояния
- Уровень поражения можно заподозрить по фазе стридора и сопутствующим симптомам, таким как кашель, срыгивание, цианоз
- Основным способом диагностики является эндоскопия, хотя рентгенографическое и ультразвуковое исследование может оказаться в ряде случаев весьма полезным
- Всем больным с врожденной патологией гортани и трахеи необходимо обследование в медико-генетической консультации
.jpg)
.jpg)
.jpg)









