Наиболее важным вопросом лечения эпилепсии является выбор первого антиэпилептического препарата (АЭП). Вполне вероятно, что пациент будет длительно принимать этот АЭП, поэтому переносимость препарата не менее важна, чем его эффективность. Общепризнанным является тот факт, что вальпроат натрия препарат первой очереди выбора в лечении генерализованных эпилепсий, что нашло свое подтверждение и в клинической практике — он назначается пациентам чаще, чем остальные АЭП [1]. Результаты исследования SANAD (сокр. от Standart and New Antiepileptic Drugs) показали, что для пациентов с идиопатической генерализованной эпилепсией или приступами, которые невозможно классифицировать, вальпроат натрия является оптимальным выбором, ламотриджин уступает ему по эффективности, топирамат — по переносимости [2].
В том, что касается препарата первой очереди выбора в лечении парциальной эпилепсии, такой определенности нет. Традиционно врачи чаще выбирают карбамазепин в качестве первой монотерапии парциальных приступов. В то же время существует целый ряд рандомизированных исследований, которые показывают, что вальпроат натрия эффективен и при парциальной эпилепсии и его эффективность сравнима с эффективностью карбамазепина [3, 4]. Исследование по сравнительной эффективности и переносимости различных АЭП в лечении парциальной эпилепсии продемонстрировало сходную эффективность вальпроата натрия и карбамазепина и несколько лучшую переносимость вальпроата [5]. Аналогичные результаты были получены de Silva et al. (1996) в педиатрической популяции [6].
Цель данного исследования: получение дополнительных данных по безопасности и эффективности вальпроата пролонгированного действия (Депакин Хроно) как первой монотерапии у пациентов с парциальной эпилепсией.
Материалы и методы. Дизайн исследования: открытое несравнительное проспективное исследование, максимально приближенное к клинической практике. Исследование проводилось в 169 центрах Российской Федерации.
Критерии включения:
-
Возраст: взрослые и дети старше 6 лет.
-
Пол: мужчины и женщины; женщины детородного возраста должны использовать надежные средства контрацепции.
-
Пациенты с вновь выявленной или недавно диагностированной парциальной эпилепсией, с вторично-генерализованными приступами или без них, требующие противоэпилептической терапии.
-
Пациенты, у которых проводимая ранее антиэпилептическая терапия была малоэффективна или недостаточно хорошо переносима и которые могли выиграть от назначения Депакина Хроно.
-
Пациенты или их родители, способные заполнять дневники пациентов (дневники регистрации приступов эпилепсии) и выполнять процедуры исследования.
-
Пациенты, у которых наблюдалось как минимум два парциальных приступа с вторичной генерализацией или без нее, на протяжении последних шести месяцев.
Пациенты, у которых отмечался только один парциальный приступ с вторичной генерализацией или без нее, могут принять участие в исследовании, если личные записи пациента, клиническое обследование, ЭЭГ, компьютерная томография или МРТ-исследование головного мозга позволяют убедительно поставить диагноз эпилепсии определенного типа после этого первого приступа.
-
Пациент, по мнению исследователя, способен пройти весь период участия в исследовании.
-
Пациент или его законный представитель (если речь идет о ребенке) должен подписать форму информированного согласия после того, как получит объяснения по сути предстоящего исследования.
Критерии исключения:
Пациенты, у которых отмечался хотя бы один из следующих критериев, не могли быть включены в исследование:
-
острый или хронический гепатит;
-
тяжелый гепатит, особенно лекарственный, в личном или семейном анамнезе;
-
гиперчувствительность к вальпроатам;
-
гепатопорфирия;
-
неэпилептические приступы в анамнезе;
-
активная инфекция ЦНС, демиелинизирующее заболевание, любое заболевание ЦНС, которое, по мнению исследователя, могло прогрессировать в ходе исследования (пациенты с небольшими опухолями мозга на ранних стадиях могли быть включены);
-
алкоголизм или наркомания в анамнезе;
-
пациентки, которые беременны, собирались забеременеть в период исследования, кормящие матери;
-
пациенты, которые принимали другой исследуемый препарат как минимум за 30 дней до первого визита.
Пациентам, включенным в исследование, назначался Депакин Хроно®. Так как Депакин Хроно является препаратом пролонгированного действия, он назначался один раз в сутки. Начальная суточная доза препарата составляла 10–15 мг/кг, затем доза увеличивалась до оптимальной. Дозу следовало увеличивать постепенно каждые 2–3 дня, для того чтобы достичь оптимальной дозы примерно в течение недели. Окончательная суточная доза для каждого пациента устанавливалась в соответствии с возрастом и массой тела пациента; кроме того, учитывалась индивидуальная чувствительность. Исследователь увеличивал дозу препарата Депакин Хроно до достижения оптимального эффекта (отсутствие приступов) или достижения максимально переносимой дозы или максимально допустимой дозы. Если оптимальный контроль над приступами не достигался при достижении максимально переносимой дозы или максимально допустимой дозы, пациент должен был быть исключен из исследования.
Сопутствующая противоэпилептическая терапия не была разрешена в ходе исследования. Все другие виды лечения были разрешены. Исследователь оценивал комплаентность пациентов на каждом визите по дневнику приступов.
Общая продолжительность исследования составила 18 месяцев (12 месяцев набор пациентов + 6 месяцев наблюдения). За время исследования осуществлялось 4 визита (скрининговый визит и визиты на 2-м, 3-м и 6-м месяцах лечения).
В исследовании оценивались следующие параметры эффективности:
-
Частота ремиссии (процент пациентов, не имевших приступов через 6 месяцев лечения, т. е. на протяжении как минимум 3 месяцев до окончания лечения).
-
Процент пациентов, закончивших 6-месячный период исследования.
-
Общая оценка невропатолога (шкала Clinical Global Impression, сокр. CGI — см. табл. 1).
-
Доза препарата, необходимая для достижения максимальной эффективности.
-
Эффективность, оцененная в соответствии с типом парциальных приступов, этиологией парциальной эпилепсии, топографической локализацией парциальной эпилепсии.
Безопасность оценивалась на основании учета сообщений о нежелательных явлениях, а также учета нежелательных явлений, приведших к выбыванию из исследования. Побочные эффекты подразделялись по степени тяжести и взаимосвязи с препаратом.
Статистическая обработка данных проводилась централизованно, качественные переменные были суммированы с помощью описательной статистики (среднее, медиана, стандартное отклонение, минимальное и максимальное значение, количество случаев и проценты).
Данное клиническое исследование было проведено в соответствии с принципами Качественной клинической практики и этическими нормами, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации.
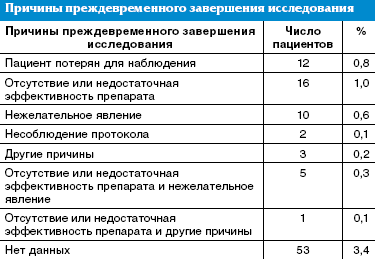
Результаты исследования. В исследование было включено 1583 пациента, однако из-за проблем с данными у 3 пациентов они были исключены из анализа, и в анализ было включено всего 1580 пациентов. Большинство пациентов — 1478/1580 (93,5%) завершило исследование согласно протоколу. Причины преждевременного завершения исследования приведены в табл. 2.
В анализируемой популяции 861/1580 (54,5%) были мужчинами и 718/1580 (45,4%) женщинами (пол одного пациента не указан). Средний возраст пациентов составил 24,7 ± 15,2 года. Средний вес пациентов составил 58,9 ± 19,7 кг.
Идиопатическая эпилепсия была диагностирована у 192/1580 (12,2%) пациентов, криптогенная эпилепсия — у 544/1580 (34,4%) пациентов, симптоматическая эпилепсия — у 795/1580 (50,3%) пациентов. Симптоматическая эпилепсия была вызвана черепно-мозговыми травмами и последствиями хирургического вмешательства — у 299/795 (37,6%) пациентов и перенесенными в детстве заболеваниями — у 208/795 (26,2%) пациентов. Ассоциированный склероз гиппокампа был зарегистрирован у 34/1580 (2,2%) пациентов. Самыми распространенными до начала лечения были вторично-генерализованные приступы — у 1153/1580 (73,0%) пациентов.
У большинства исследуемых регистрировался только один эпилептический фокус — у 1490/1580 (94,3%) пациентов, у 70/1580 (4,4%) пациентов — два эпилептических фокуса. Самым распространенным очагом поражения был височный фокус, отмеченный у 637/1580 (40,3%) пациентов. Исключительно височная локализация эпилептического фокуса была отмечена у 575/1580 (36,4%) пациентов и исключительно лобная локализация была отмечена у 405/1580 (25,6%) пациентов.
Анализ эффективности терапии. Шестимесячный период исследования завершили 1478 пациентов (93,5%). Через 6 месяцев лечения у 1167/1580 (73,9%) пациентов на фоне приема Депакина Хроно наступила ремиссия. В ходе анализа была оценена эффективность (частота ремиссии), в соответствии с типом парциальных приступов, этиологией парциальной эпилепсии и топографической локализацией парциальной эпилепсии.
Анализ собранных данных показал наличие статистически значимого линейного тренда (p < 0,001) — уменьшения частоты всех видов эпилептических приступов от исходного уровня к визиту 3. В анамнезе простые парциальные приступы были зарегистрированы у 697/1580 (44,1%) пациентов. После проведенного лечения наличие простых парциальных приступов отмечали у 197/1541 (12,8%) пациентов.
Аналогичной была ситуация и при сложных фокальных и вторично-генерализованных приступах. Сложные парциальные приступы в анамнезе присутствовали у 672/1580 (42,5%) пациентов. После проведенного лечения наличие сложных парциальных приступов отмечалось у 139/1537 (9,0%) пациентов. Вторично-генерализованные приступы отмечались в анамнезе у 1153/1580 (73,0%) пациентов. После проведенного лечения наличие вторично-генерализованных приступов отмечалось у 137/1534 (8,9%) пациентов.
На фоне лечения у 67,9% от общего числа (1073/1580) пациентов наблюдалось выраженное и значительное улучшение состояния при отсутствии побочных эффектов (по шкале CGI — шкала приведена в табл. 1), у 9,3% пациентов (147/1580) аналогичное улучшение состояния сопровождалось побочными эффектами, не оказывающими значительного влияния на активность. У 13,0% пациентов (206/1580) наблюдалось умеренное или частичное улучшение состояния, у 2,7% (43/1580) пациентов — минимальное или незначительное улучшение. Состояние не изменилось или ухудшилось у 1,5% пациентов (23/1580), при этом у 0,1% пациентов были отмечены побочные эффекты, перевешивавшие терапевтическое действие (1/1580).
Среднее значение дозы препарата Депакин Хроно, назначаемой врачами-исследователями для достижения максимальной эффективности, на визите 1 составило 1026,8 ± 379,4 мг/сутки; на визите 2 — 1188,4 ± 438,4 мг/сутки; на визите 3 — 1268,0 ± 494,4 мг/сутки. Средняя доза, при которой достигалась максимальная эффективность, в зависимости от типа приступов на исходном уровне, была следующей: вторично-генерализованные приступы — 1086,7 ± 428,0 мг/сутки, простые парциальные и вторично-генерализованные — 1216,6 ± 446,5 мг/сутки и сложные парциальные и вторично-генерализованные 1308,2 ± 513,3 мг/сутки. Для пациентов с исключительно височной локализацией эпилептического фокуса средняя доза максимальной эффективности составила 1161,1 ± 449,9 мг/сутки и для пациентов с исключительно лобной локализацией максимальная эффективность достигалась при средней дозе в 1248,3 ± 481,8 мг/сутки.
Переносимость терапии. В ходе исследования у 175/1580 (11,1%) пациентов были зарегистрированы нежелательные явления. Нежелательные явления, связанные с приемом исследуемого препарата, были зарегистрированы у 139/1580 (8,8%) пациентов. Наиболее частыми побочными эффектами, связанными с приемом исследуемого препарата, были увеличение массы тела, отмеченное у 28/1580 (1,8%) пациентов, и выпадение волос, отмеченное у 28/1580 (1,8%) пациентов, а также тремор, зарегистрированный у 24/1580 (1,5%) пациентов. Большинство побочных эффектов расценивались врачами как легкие или умеренной степени выраженности, и они только в 0,6% всех случаев (10/1580) служили поводом для отмены препарата. Нежелательные явления, не связанные с приемом препарата, были зарегистрированы у 36/1580 (2,3%) пациентов. Только у 1/1580 (0,1%) пациентки в ходе исследования было зарегистрировано серьезное нежелательное явление. На 8-й неделе лечения у пациентки развилась стойкая тромбоцитопения. Исследуемый препарат был отменен.
Обсуждение полученных результатов. Дизайн исследования позволяет оценить долгосрочную эффективность применения Депакина Хроно. Продолжительность исследования, равная 6 месяцам, считается адекватной для оценки эффективности и переносимости антиэпилептической терапии [7]. Популяция пациентов (n = 1580) на наш взгляд представляется достаточной для того, чтобы делать определенные выводы.
Полученные в исследовании данные о высокой частоте ремиссий при парциальной эпилепсии при применении Депакина Хроно (у 1167 пациентов из 1580 или 73,9%) соответствуют результатам схожих международных исследований [6, 7] и свидетельствуют о высокой эффективности препарата. Депакин Хроно обладает сравнимой эффективностью при всех типах парциальных приступов — простых, сложных и вторично-генерализованных. Следует отметить, что в лечении самых тяжелых типов приступов — вторично-генерализованных препарат оказался даже более эффективным, чем в лечении приступов без генерализации (68,4% ремиссий при простых парциальных приступах (476/697), 71,1% (477/672) и 74% (853/1153) — при сложных фокальных и вторично-генерализованных соответственно). .
Отмечена высокая эффективность Депакина Хроно при идиопатических фокальных эпилепсиях, что неудивительно, так как это в основном доброкачественно текущие формы эпилепсии. Правда, ранее такая высокая эффективность описывалась только при идиопатических генерализованных эпилепсиях [2]. Замечателен высокий процент ремиссий (68% или 795/1580) при симптоматических фокальных эпилепсиях, в доступной литературе обычно описываются более низкая частота возможных ремиссий при этих формах — от 45% до 56–57% [4]. Несколько меньшая эффективность препарата при эпилепсии с височной локализацией фокуса по сравнению с лобной локализацией возможно объясняется наличием в обследованной популяции пациентов с темпоральным склерозом.
Существует достаточно распространенное заблуждение, что стойкой ремиссии при эпилепсии невозможно добиться, если пациент не получает высоких доз вальпроата. В нашем исследовании ремиссия достигалась на относительно невысоких суточных дозах Депакина Хроно (1268,0 ± 494,4 мг при среднем весе пациентов 58,9 ± 19,7 кг). Полученный результат может также косвенно подтвердить национальную традицию вести пациентов на более высоких дозах вальпроата, чем принято в европейских странах. В аналогичном по дизайну исследовании Jedrzejczak J. с соавт. (2008) средняя суточная терапевтическая доза вальпроата составила 683 мг для детей и 987 мг для взрослых, что все-таки ниже, чем в нашем исследовании [7].
Вопрос средних терапевтических доз имеет принципиальный характер, так как большинство побочных эффектов вальпроата — дозозависимые и наблюдаются на дозах, близких к 30 мг на кг веса. Ведение пациента на относительно невысоких, но терапевтических (эффективных) дозах обеспечивает хорошую переносимость терапии. Данное исследование демонстрирует низкий процент побочных эффектов при терапии Депакином Хроно — 8,8% (у 139 из 1580 пациентов), т. е. примерно у каждого 9-го пациента. Большинство побочных эффектов по степени выраженности были легкими или умеренно выраженными и не служили поводом для отмены препарата (такая ситуация отмечена только у 10 пациентов из 1580, что составило 0,6%). Спектр и частота побочных эффектов соответствует таковым в схожих исследованиях [6, 7]. Следует уточнить, что в этом исследовании не оценивались тератогенные эффекты вальпроата.
Обращает на себя внимание высокий уровень удержания на препарате (как интегративный показатель хорошей эффективности и переносимости) — к концу 6-го месяца терапии Депакин Хроно продолжали принимать 1478 пациентов из 1580 (93,5%).
Наше исследование не носило сравнительного характера, поэтому мы не можем с полной уверенностью утверждать, что вальпроат в лечении парциальной эпилепсии более эффективен, чем карбамазепин и окскарбазепин. Но результаты данного наблюдательного несравнительного исследования убедительно свидетельствуют о том, что Депакин Хроно можно успешно и безопасно использовать как препарат первой очереди выбора в лечении парциальной эпилепсии у детей и взрослых.
Литература
-
Glauser T., Ben-Menachem E., Bourgeois B. et al. ILAE Treatment Guidelance: Evidence-based Analysis of Antiepileptic Drug Efficasy and Effectiveness as Initial Monotherapy for Epileptic Seizures and Syndromes // Epilepsia. 2006; v. 47 (7); p. 1094–1120.
-
Marson A. G., Al-Kharusi A. M., Alwaidh M. et al. The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalized and unclassifiable epilepsy: an unblended randomized controlled trial // Lancet. 2007; v. 369; p. 1016–1026.
-
Beydoun A., Sackellares J. C., Shu V. Safety and efficacy of divalproex sodium monotherapy in partial epilepsy: a double-blind, concentration-response design clinical trial. Depakote Monotherapy for Partial Seizures Study Group // Neurology; 1997; v. 48; p. 182–188.
-
Criste W., Kramer G., Vigonius U. et al. A double-blind controlled clinical trial: oxcarbazepine versus sodium valproate in adults with newly diagnosed epilepsy // Epilepsy Reseach. 1997; v. 26; p. 451–460.
-
Heller A. J. Chesterman P., Elwes R. D. et al. Phenobarbitone, phenitoin, carbamazepine or sodium valproate for newly diagnosed adult epilepsy; a randomized comparative monotherapy tria // Journal of Neurology, Neurosurgery and Psychiatry. 1995; v. 58; p. 44–50.
-
De Silva M., VacArdle B., McGowan M. et al. Randomised comparative monotherapy trial of phenobarbitone, phenytoin; carbamazepine or sodium valproate for newly diagnosed childhood epilepsy // Lancet. 1996; v. 347; p. 709–713.
-
Jedrzejczak J., Kuncikova M, Magureanu S. On Behalf of the VIPe Study Group//European Journal of Neurology. 2008; v. 15; p. 66–72.
Е. Д. Белоусова, доктор медицинских наук, профессор
МНИИ педиатрии и детской хирургии Росмедтехнологий, Москва
Контактная информация об авторе для переписки: 125412, Москва, ул. Талдомская, д. 2
Купить номер с этой статьей в pdf









