В отечественной и зарубежной литературе проблеме атопического дерматита (АД) посвящены сотни статей и монографий. Несмотря на столь пристальное внимание к данной проблеме, следует констатировать и рост числа больных, страдающих АД, и недостаточную эффективность используемых методов лечения. На сегодняшний день отсутствует общепризнанное определение данного заболевания.
АД (атопическая экзема, синдром атопической экземы/дерматита) — хроническое аллергическое воспалительное заболевание кожи, сопровождающееся зудом, возрастной морфологией высыпаний и стадийностью [1]. В определении АД, приведенного в согласительном документе Ассоциации детских аллергологов и иммунологов России, подчеркивается еще и гетерогенность механизмов, участвующих в формировании данного заболевания.
АД является хроническим аллергическим лихенифицирующим воспалением кожи, возникающим в результате готовности иммунной системы к развитию аллергической реакции, способной быть запущенной как атопическими, так и неатопическими механизмами. Сопровождается зудом и частым инфицированием [3].
Достижения иммунологии с середины 90-х годов прошлого столетия привели к пониманию сути основных изменений, происходящих у некоторых больных с аллергическим поражением кожи. Признание главенствующей роли атопии в генезе нескольких вариантов аллергического дерматита привело к попытке объединения их в диагнозе АД. Диагноз АД объединил ранее существующие диагнозы, такие как «нейродермит», «диатезное пруриго», «пруриго Бенье», «эндогенная экзема», «экссудативный экзематоид», «астма-экзема», «конституциональная экзема», «экссудативный диатез», «аллергический диатез», «детская экзема», «истинная экзема», «пеленочный дерматит» и многие другие. Следует признать, что некоторые из перечисленных терминов до настоящего дня используются в Европе. Это существенно затрудняет проведение эпидемиологических исследований с целью выяснения истинного числа больных детей, страдающих АД. По результатам стандартизированного международного эпидемиологического исследования ISAAC (Internetional Study of Asthma and Allergy in Childhood — международное исследование астмы и аллергии у детей) распространенность АД у детей в США достигла 17%, в Европе — 15,6%, в Российской Федерации составила от 6,2% до 15,5%. Отмечается постоянная тенденция к росту числа больных детей, страдающих АД, в мире [3].
Согласно основополагающим документам Европейской комиссии по номенклатуре заболеваний (2002, 2004) существуют пациенты с «атопической экземой/дерматитом», у которых имеет место IgE-зависимый механизм, и больные, у которых нет данных за IgE-зависимый механизм (рис. 1).

В то же время в современной западной дерматологии «атопия» — это клинический диагноз, и заболевание может называться «атопическим» даже без подтверждения кожными тестами или присутствия IgE-антител в его сыворотке. Большинством экспертов Европейской комиссии по номенклатуре заболеваний признается необходимость создания нового термина для «атопической экземы/дерматита».
В нашей стране существует рабочая классификация АД, предложенная РААКИ (Российской ассоциацией аллергологов и клинических иммунологов) в 2002 году. К сожалению, практикующие врачи редко используют ее в своей работе, ограничиваясь указаниями лишь на период ремиссии или обострения заболевания (табл. 1).
По мнению большинства исследователей АД следует относить к мультифакторным заболеваниям с полигенным типом наследования с пороговым эффектом. При сочетании определенных генетических дефектов и средовых факторов достигается пороговое значение, при котором и появляется клиническая картина заболевания. Существует большое количество фенотипически здоровых людей с высоким риском формирования аллергических заболеваний в неблагоприятных условиях внешней среды.
При выраженных наследственных дефектах достаточно воздействия незначительных средовых факторов, чтобы очень быстро предрасположенность к развитию аллергического заболевания реализовалась в виде заболевания. И наоборот, агрессивные факторы внешней среды даже при минимальных генетических дефектах могут привести к быстрому формированию АД.
Достижения фундаментальных научных исследований в области молекулярной медицины привели сегодня к пониманию сути биологических дефектов, происходящих у больных с АД.
В современной литературе собрано большое количество наблюдений, указывающих на связь аллергических заболеваний у родителей или родственников больного с появлением каких-либо аллергических проявлений у детей. Если оба родителя ребенка страдают атопическим заболеванием, то риск формирования АД по разным данным составляет от 50% до 80%, если наследственность отягощена по материнской линии, то риск развития аллергического (атопического) заболевания составляет от 30% до 50% [12].
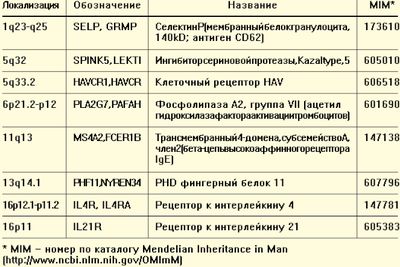
В настоящее время описано более 20 генов-кандидатов, ответственных за формирование АД. Уже в 21 веке описали 13 новых полиморфизмов, связанных с формированием аллергического поражения кожи, расположенных главным образом на хромосомах 1q, 3q и 17q.
Учитывая достижения современной молекулярной медицины, можно выделить несколько групп кандидатных генов, контролирующих возможность формирования АД.
-
1 класс — гены, предрасполагающие к атопии (увеличению общего IgE).
-
2 класс — гены, влияющие на IgE-ответ.
-
3 класс — гены гиперреактивности кожи, не зависимой от атопии.
-
4 класс — гены, формирующие воспаление путем воздействия «воспалительных» цитокинов независимо от IgE.
Предрасположенность к атопии связывают преимущественно с локусами 1q23-q25, 13q14.1, 11q12-q13, 6p21.2-p12, 5q33.2, 5q32 (табл. 2).
Безусловно, основным, но не единственным механизмом формирования АД следует признать аллергические реакции 1-го типа (атопические, типа анафилаксии) по классификации Джелла и Кумбса. Какие бы типы аллергических реакций не принимали участие в формировании данного заболевания, ключевым звеном патогенеза АД является выработка у этих больных провоспалительных цитокинов и хемокинов, ответственных за формирование хронического аллергического воспаления. Это в первую очередь IL-4 и рецептор к IL-4, IL-5, IL-6, IL-10, IL-13, IL-18, TGF-бета1 (трансформирующий фактор роста-бета), TNF-альфа (фактор некроза опухоли-альфа), GM-CSF (грануляцитарно-макрофагальный колониестимулирующий фактор), IFN-гамма (интерферон-гамма). Для полноценной аллергической реакции необходимо формирование большого количества хемокинов, ответственных за хемотаксис моноцитов, базофилов (CCL2), индуцирование и привлечение (CCL11 или Eotaxin) в место аллергической реакции эозинофилов, выделения содержимого гранул эозинофилов (CCL5 или RANTES) [8]. Кожа больных с АД отличается особой сухостью и ранимостью. Одним из механизмов предрасположенности к изменению барьерной функции кожи являются изменения в гене, кодирующем белок — филаггрин (filaggrin). Лица с мутациями в гене, кодирующем filaggrin, предрасположены к формированию вульгарной формы ихтиоза и синдрома атопической экземы/дерматита. Filaggrin — защитный белок, который обычно экспрессируется в клетках кожи. Он действует как физический барьер, препятствующий воздействию потенциально опасных веществ из окружающей среды. Ученые выдвинули гипотезу, что наследование одного или двух дефектных генов filaggrin может ослаблять этот физический барьер, снижая его эффективность, и тем самым повышать риск формирования аллергического поражения кожи [10, 11, 13].
Клинические проявления АД у детей, как правило, появляются на первом году жизни в виде экссудативного типа кожного поражения. В первую очередь страдает лицо, шея, туловище и разгибательные поверхности конечностей. Существует мнение, что у больных с АД имеет место стадийность в типах кожного поражения. Начинается в виде младенческой формы, затем формируется детская и завершается взрослым типом. У некоторой части больных такая эволюция клинической картины может иметь место. Однако у многих больных одновременно отмечаются как типичные признаки младенческой формы (экссудативный тип поражения), так и лихеноидные высыпания в естественных складках кожи. Предлагается выделять экссудативную, эритематозно-сквамозную и лихеноидную формы АД [2, 4].
При экссудативной форме АД в периоде обострения заболевания выявляется гиперемия, отек кожи, папулы, везикулы, эрозии и мокнутия. Обычно первые элементы появляются на лице, чаще симметрично, и сопровождаются сильным зудом. Постепенно процесс распространяется на ранее неизмененные участки кожи, пузырьки вскрываются, образуя большую эрозивную поверхность, покрытую в дальнейшем корками. На лице в первую очередь страдают щеки, лоб и волосистая часть головы. Аналогичные изменения могут появляться и в естественных складках (локтевые, подмышечные и ягодичные области).
При эритематозно-сквамозной форме АД в периоде обострения у больных появляются эпидермодермальные папулы, сопровождающиеся сильным зудом и как следствие этого появлением у больных расчесов на фоне сухости кожи.
При преобладании в клинической картине заболевания лихеноидной формы АД в фазе обострения отмечается инфильтрация и лихенификация кожи на фоне эритемы и умеренного отека. Отмечается, как правило, выраженная сухость кожных покровов и признаки лихенификации — утолщение и усиление кожного рисунка. Процесс в основном сконцентрирован в естественных складках и сгибах. Основным элементом при данной форме АД являются эпидермодермальные папулы, склонные к слиянию. У больных отмечается сухость кожных покровов, шелушение и зуд. Постепенно с прогрессированием процесса возникает гиперпигментация в месте воспаления и трещины.
При остром течении АД преобладает, как правило, экссудативный компонент воспаления, что сопровождается выраженным отеком кожи, гиперемией и мокнутием.
В подостром периоде АД отмечается постепенное уменьшение отека, гиперемии и мокнутия. При лихеноидной форме заболевания выявляется очаговая инфильтрация, лихенификация, сухость и шелушение кожи. На месте очагов воспаления возможно появление участков депигментации.
У больных с пруригоподобной формой заболевания появляются множественные изолированные плотные папулы, на вершине которых выявляются мелкие везикулы. Эти высыпания появляются на фоне лихенифицированно измененной кожи, чаще в области естественных складок и сгибах. Следует подчеркнуть, что основным проявлением заболевания является интенсивный зуд.
В периоде неполной ремиссии заболевания у больных АД сохраняются минимальные проявления в виде очагов шелушения, сухости, единичных экскориаций. В период полной ремиссии могут отмечаться шелушение, сухость и очаги гипер- или гипопигментации, признаки атрофии кожи. Для оценки степени тяжести кожного процесса в нашей стране принято использовать индекс SCORAD (1993). Этот коэффициент позволяет объективно оценить степень тяжести заболевания, однако в практической работе редко используется. В практической работе врачи опираются на следующие критерии тяжести:
Легкое течение заболевания характеризуется незначительной гиперемией, экссудацией и шелушением. У больных появляются единичные папулы и везикулы. Зуд слабый и сопровождается единичными расчесами. Сон не нарушен. Реакции региональных лимфоузлов нет.
Среднетяжелое течение заболевания проявляется множественными очагами поражения кожи с выраженной экссудацией и/или лихенификацией. У больных отмечается умеренный зуд и расчесы. Выявляется умеренное увеличение региональных лимфоузлов.
Тяжелое течение характеризуется диффузными изменениями кожных покровов, выраженной экссудацией и/или лихенификацией, эрозиями. Отмечается мучительный зуд, нарушающий общее самочувствие. Реакция всех групп лимфатических узлов. Особенно тяжелое течение заболевания наблюдается у детей с поражением кожи в виде эритродермии, требующей, как правило, назначения системных глюкокортикоидов.
Диагностические критерии АД
По мнению большинства специалистов, диагноз АД базируется на клинических признаках, так как нет ни одного лабораторного или иного критерия, который бы сразу верифицировал данное заболевание. Как не существует общепринятого определения этого заболевания, так и не существует единых критериев постановки диагноза. Хорошо известны критерии АД J. M. Hanifin и G. Rajka (1980), выделивших 4 главных критерия и более чем 20 дополнительных. Для верификации диагноза требовалось, по крайней мере, по 3 критерия из обеих групп [9]. В 1994 году эти критерии были пересмотрены в Лиллехамере (Норвегия) с целью минимизации признаков. Однако и эти критерии не нашли широкого применения в повседневной работе врача-педиатра.
Достаточно привлекательными выглядят критерии, разработанные экспертами в Великобритании и представленные в виде Согласительного документа «Атопическая экзема у детей» в декабре 2007 [7]. АД должен быть диагностирован, когда у ребенка есть кожный зуд плюс три или более из следующих признаков:
-
наличие дерматита в области сгибательной поверхности конечностей, вовлекающего складки кожи (локтевые или подколенные сгибы) или наличие дерматита на щеках и/или на разгибательных поверхностях конечностей у детей до 18 месяцев;
-
наличие дерматита в анамнезе в области сгибательной поверхности конечностей (или дерматита на щеках и/или на разгибательных поверхностях конечностей у детей до 18 месяцев);
-
распространенная сухость кожи за последние 12 месяцев;
-
наличие бронхиальной астмы или аллергического ринита (или наличие атопических заболеваний у родственников первой линии родства);
-
начало дерматита до двух лет.
Чувствительность данного набора критериев составила 85%, а специфичность — 96% [10].
В 2008 г. опубликованы диагностические критерии АД в клинических рекомендациях для педиатров в разделе аллергология и иммунология под редакцией академиков А. А. Баранова и Р. М. Хаитова (табл. 3).
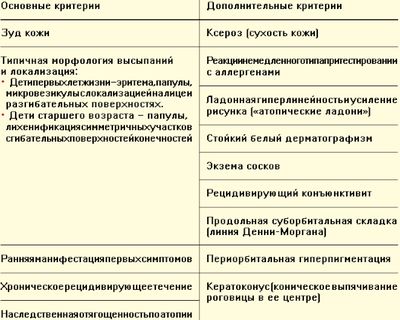
Дополнительные критерии помогают заподозрить АД, но не являются специфическими.
Таким образом, диагностика АД базируется на основных клинических признаках: наличие дерматита с типичной локализацией (в зависимости от возраста), распространенным зудом и сухостью кожных покровов. При наличии сопутствующего аллергического поражения респираторного тракта (аллергический ринит, бронхиальная астма), со сходным атопическим механизмом, естественно предположить, что и кожные проявления имеют аналогичный иммунный дефект. Большое диагностическое значение имеют: отягощенная наследственность по атопическим заболеваниям, прямые или косвенные признаки, указывающие на связь обострения дерматита с неинфекционными аллергенами (пищевыми, эпидермальными, пыльцевыми) и положительный эффект элиминации.
Лабораторные и специальные методы диагностики
Исследование уровня общего и аллергенспецифичных IgE имеет важное значение у больных с АД. Особенно важно это исследование у больных с пищевой аллергией, проявляющейся в виде АД. Определение IgE специфических антител позволяет выявить основные неинфекционные аллергены, вызывающие обострение АД. Однако следует учитывать, что отсутствие IgE-антител не исключает атопический характер заболевания. Бывают ложноотрицательные результаты данного тестирования, особенно часто выявляемые у детей первых двух-трех лет жизни. Не следует забывать, что причинными для детей с АД могут быть и ингаляционные аллергены (домашняя пыль, клещи домашней пыли Dermatophagoides pteronyssinus или Dermatophagoides farinae, эпидермальные аллергены и пыльца растений, грибковые аллергены). Появление обострения АД у детей после контакта с домашними животными, шерстяными или меховыми изделиями, ухудшение течения заболевания в весенне-летний период — все это указывает на возможность сенсибилизации к неинфекционным аллергенам. Иногда бывает вполне достаточно исключить из окружения больного с АД домашних животных, поменять «пуховик» на одежду из современных синтетических материалов, и у больного уменьшаются или вообще купируются все клинические проявления АД. Поэтому вопросам диагностики сенсибилизирующих факторов следует уделять особое внимание. Патогенетически необоснованным выглядит попытка выявления сенсибилизации у больных с АД с помощью определения IgG-антител. Большинство антител класса IgG (возможно, кроме IgG4) относятся к блокирующим антителам и не имеют никакого диагностического значения.
В последние годы все большее внимание стали уделять диагностике бактериальной и грибковой сенсибилизации у больных с АД. Определение антител класса Е к Staphylococcus aureus и его экзотоксинам у больных с АД позволяет ряду специалистов предположить патогенетическое значение этого фактора. Тем более что у подавляющего числа больных с обострением АД обнаруживают стафилококковое обсеменение как пораженных, так и непораженных участков кожи [5]. Этих данных пока недостаточно, чтобы окончательно сделать вывод о значение IgE-антител к St. aureus в патогенезе АД.
Нельзя считать до конца решенными и споры вокруг значения определения IgE-антител к некоторым грибковым аллергенам. Чаще всего обнаруживаются грибы Malassezia furfur (Pityrosporum ovale и Pityrosporum orbiculare) у больных с АД [6]. Данный дрожжевой гриб заселяет кожу всех людей, и роль и значение его в патогенезе АД пока остаются неясными.
Другим методом диагностики неинфекционной сенсибилизации у больных АД является постановка кожных проб (тест уколом, кожно-скарификационные тесты, аппликационные тесты). Метод кожного тестирования хорошо себя зарекомендовал при диагностике бытовой и пыльцевой сенсибилизации. В диагностике пищевой сенсибилизации данный метод обследования занимает более скромное место. Большая частота ложноотрицательных и значительно реже встречающихся ложноположительных результатов предполагает необходимость проведения элиминационно-провокационных тестов, особенно важных для подбора индивидуальной диеты.
«Золотым стандартом» диагностики пищевой аллергии является двойная слепая плацебо-контролируемая проба. Обследуемому больному после периода элиминации вводят в питание проверяемый продукт в замаскированном виде. Кроме того, пациент получает и плацебо. При этом ни пациент, ни его родители не знают, что именно в данный момент вводится в питание. К сожалению, проведение провокации по вышеописанной схеме проводится только с научно-исследовательской целью. В практике врача-аллерголога встречается открытый пищевой провокационный тест, когда и пациент и его родители знают, какой конкретно пищевой продукт вводится больному. В ходе проведения провокации у пациента фиксируются клинические проявления обострения АД.
Дифференциальный диагноз следует проводить с большим кругом кожных, инфекционных, метаболических, неопластических и иммунодефицитных заболеваний (табл. 4).

Лечение
Современная стратегия лечения АД должна включать следующие направления (рис. 2):
-
устранение причинных факторов (аллергенных и неаллергенных), вызывающих обострение заболевания;
-
местную наружную (противовоспалительная, увлажняющая, восстановление липидного барьера кожи) терапию;
-
системную терапию (антигистаминные препараты, циклоспорин А, фототерапия, системные кортикостероиды, антибактериальные препараты, иммунотерапия). Системная терапия АД применяется только в случае неэффективности элиминационных мероприятий и наружной терапии или при присоединении осложнений (бактериальных, вирусных, грибковых).
У детей первого года жизни, страдающих АД, дебют заболевания чаще всего связан с пищевой аллергией. Постепенно с возрастом связь обострения АД с приемом пищевого аллергена не всегда прослеживается, в связи с чем значение строгой элиминации у больных АД детей старшей возрастной группы ставится под сомнение. Основная проблема в данном случае связана с недостаточно эффективными лабораторными методами диагностики пищевой аллергии, широко используемыми в практике. Следует еще раз подчеркнуть необходимость выявления всех причинных факторов, приводящих к формированию и обострению АД. Это в полной мере касается элиминационных диет, используемых у больных с пищевой аллергией, проявляющейся в виде АД. Нормализация диеты кормящей матери, использование при необходимости гидролизатов коровьего молока высокой степени, аминокислотных смесей позволяют добиться полной пищевой элиминации у большинства детей первого года жизни. Не следует забывать, что сенсибилизация у детей возможна при употреблении любого продукта питания (злаки, овощи, мясо, фрукты). Попытка частичной элиминации неэффективна и в большой степени вредна.
Элиминационные меры касаются не только пищевых аллергенов, но и бытовых и пыльцевых аллергенов. Устранение контакта больного ребенка с домашними животными, изделиями из шерсти, некоторых синтетических тканей и меха может существенно уменьшить клинические проявления АД. Создание гипоаллергенной диеты и быта — это необходимые условия достижения ремиссии АД у детей.
Учитывая патогенетические механизмы формирования АД, наружная (топическая) терапия абсолютно необходима каждому больному. Стандартная схема местной терапии АД включает противовоспалительные (гормональные и негормональные) средства и средства, относящиеся к так называемой лечебной косметике, восстанавливающие барьерные функции кожи.
Из наружных глюкокортикостероидов (ГКС) у детей следует применять препараты, обладающие минимальными побочными эффектами, при сохранении высокой степени противовоспалительного действия. В настоящее время в педиатрической практике чаще всего используются препараты последнего поколения — метилпреднизолона ацепонат (Адвантан), алклометазона дипропионат (Афлодерм) и мометазона фуроат (Элоком). Наружные ГКС назначают, как правило, короткими курсами с последующим переходом на нестероидные местные препараты. Следует с осторожностью назначать местные ГКС на чувствительные участки кожи и использовать только средства, относящиеся к 1 классу активности. При тяжелых обострениях АД возможно использование местных ГКС, относящихся к 3 классу активности (сильные) на туловище и конечностях. В случае присоединения бактериальных осложнений используют комбинированные препараты, содержащие местные ГКС, антибактериальные и противогрибковые препараты (Тридерм, Пимафукорт).
Пимекролимус (Элидел) — препарат из класса макролактамов, производное аскомицина. Пимекролимус связывается с молекулой макрофилина-12, что приводит к блокаде проведения внутриклеточного сигнала и подавлению синтеза провоспалительных цитокинов (IL-2, 3, 4, 5, IFN-гамма). Пимекролимус в форме 1% крема используется 2 раза в день. Особым преимуществом пимекролимуса следует считать возможность использования его на всех без исключения пораженных участках кожи. В связи с недоказанной безопасностью при длительном применении (> 1 месяца) ингибиторы кальциневрина признаны препаратами второй линии терапии АД, в то время как топические ГКС — препаратами первой линии [8].
В этом отношении представляют интерес препараты линии Скин-кап, которые содержат в качестве основного действующего вещества активированный пиритион цинка 0,2% в креме и аэрозоле и 1% в шампуне. Пиритион цинка — это комплексное органическое соединение цинка, практически нерастворимое в воде и стабильное в диапазоне рН 4,5–9,5. При изготовлении препаратов линии Скин-кап используются физико-химические методы активации цинка путем воздействия электромагнитного поля. Скин-кап оказывает выраженное противовоспалительное, антибактериальное и противогрибковое действие. Аэрозоль и крем Скин-кап разрешены к применению у детей с первого года жизни.
АД требует особого ухода за кожей как в период обострения заболевания, так и в период ремиссии. Основной целью общего ухода за кожей является гидратация кожи и восстановление барьерной функции. Регулярное использование смягчающих/увлажняющих средств имеет чрезвычайно важное значение для кожи. Входящие в состав увлажняющих средств эмульсификаторы влияют на барьерную функцию кожи, а церамидсодержащие липидные компоненты снижают трансэпидермальную потерю воды через кожу. В целом увлажняющие средства делают атопическую кожу менее чувствительной к ирритантам. В последнее время для уменьшения сухости кожи у пациентов, у которых применение смягчающих и увлажняющих средств оказалось малоэффективным, разработана новая линия препаратов, способных влиять на внеклеточную мембрану эпидермиса, — так называемые церамиддоминирующие смягчающие средства [3].
Для ухода за кожей существуют различные средства лечебно-косметической серии типа Мустела СтелАтопия (Mustela), Авен (Avene), А-Дерма (A-Derma), Топикрем (Nigy Charlieu), Виши (Vichy), Урьяж (Uriage), Биодерма (Bioderma). Для устранения сухости кожи используют также Бепантен, F-99, Драполен, крем Унна. К наружной терапии относят также препараты, содержащие антигистаминные средства (Фенистил гель).
Прурисед крем (Uriage) представляет собой эмульсию «вода в масле». Содержит 8% каламина, линолевую и гамма-линоленовую кислоты. Оказывает быстрое успокаивающее, противозудное действие (2 часа), прогрессивно уменьшает частоту приступов зуда. Вся косметическая линия Урьяж (Uriage) создана на основе целебных термальных вод и удовлетворяет всем основным потребностям кожи у больных с АД. Термальная вода Урьяж (Uriage) — природная изотоническая вода, содержащая уникальную концентрацию минеральных элементов, нейтральный pH, и поэтому прекрасно увлажняет, защищает и успокаивает кожу.
Для смягчения и увлажнения кожи больных с АД используют: Топикрем, Липикар бальзам, эмульсия Липикар; Мустела СтелАтопия крем-эмульсия, успокаивающий крем А-Дерма. В период обострения заболевания — крем Атодерм P. O. цинк, линия Трикзера, линия А-Дерма Эгзомега и другие. В период ремиссии заболевания используют: Топикрем, Мустела СтелАтопия крем-эмульсия, крем Атодерм, Урьяж Cu-Zn-гель, Авен Трикзера, А-Дерма Эгзомега, Иктиан крем.
Активное использование в последние годы местной ГКС-терапии позволило добиться более легкого течения обострения заболевания. Это, безусловно, глобальное достижение. Однако формирование длительной ремиссии заболевания, без опасности развития побочного действия медикаментозной терапии, крайне затруднительно. Одна из главных причин недостаточного эффекта проводимой терапии это попытка «забыть», что АД — это гетерогенное заболевание. Гетерогенность АД касается в первую очередь этиологии и патогенеза заболевания. Гетерогенность эволюции данного заболевания (особенно ярко прослеживаемая у детей), обусловленная различными патогенетическими формами заболевания, подразумевает использование различных подходов к профилактике и лечению АД у детей.
Литература
-
Баранов А. А., Хаитов Р. М. Аллергология и иммунология. М.: Союз педиатров России, 2008, С. 35–74.
-
Балаболкин И. И., Гребенюк В. Н. Атопический дерматит у детей. М.: Медицина, 1999, 240 с.
-
Современная стратегия терапии атопического дерматита: программа действий педиатра. Согласительный документ Ассоциации детских аллергологов и иммунологов России. М., 2004.
-
Короткий Н. Г., Смирнова Н. С. Современное состояние и перспективы развития терапии атопического дерматита у детей // Материалы науч.-практ. конф. М., 1996. С. 98–101.
-
Мокроносова М. А., Максимова А. Е., Батуро А. П. Влияние различных методов наружной терапии на колонизацию кожи Staphylococcus aureus и течение атопического дерматита // Рос. аллергол. журнал. 2004; 1: 58–61.
-
Мокроносова М. А., Глушакова А. М., Смольникова Е. В., Чернов И. Ю. Гиперчувствительность к грибам рода Mallasezia у больных атопическим дерматитом // Рос. аллергол. журнал. 2008; 2: 28–31.
-
Atopic eczema in children. Management of atopic eczema in children from birth up to the age of 12 years / National Collaborating Centre for Women’s and Children’s Health Published by the RCOG Press at the Royal College of Obstetricians and Gynaecologists, 27 Sussex Place, Regent’s Park, London NW1 4 RG, 2007. P. 30–32.
-
Akdis С. A. et al. Review article Diagnosis and treatment of atopic dermatitis in children and adults: Europen Academy of Allergology and Clinical Immunology / American Academy of Allergy, Asthma and Immunology/PRACTALL Consensus Report // Allergy. 2006. Vol. 61. P. 969–987.
-
Hanifin J. M., Rajka G. Diagnostic features of atopic dermatitis // Acta derm Venerol. 1980; 92: 44–474.
-
Morar N., Willis-Owen S. A. G., Moffatt M. F. CooksomWOCM. The genetics of atopic dermatitis // J Allergy Clin Immunol. 2006; 118: 24–34.
-
Palmer C. N., Irvine A. D., Terron-Kwiatko wski A., Zhao Y., Liao H., Lee S. P. et al. Common function variant of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis // Nat Genet. 2006; 38: 441–446.
-
Schultz-Larsen F. Atopic dermatitis a genetic epidemiologic study in population based twin study // J Am.Acad. Dermat. 1993. V. 28. P. 719–723.
-
Weidinger S., Illig T., Baurecht H. Loss-of-function variations within the filaggrin gene predispose for atopic dermatitis with allergic sensitizations // J. Allergy Clin. Immunol. 118 (1): 214–219.
Г. А. Новик, доктор медицинских наук, профессор СПбГПМА, Санкт-Петербург
Рис. 2. Ступенчатая терапия АД (EAACI, PRACTALL)
Купить номер с этой статьей в pdf









