Бифидобактерия была впервые изолирована Анри Тиссье (Пастеровский институт) у новорожденного, получавшего грудное кормление, и названа им Bacillus bifidus communis. Тиссье утверждал, что бифидобактерии могут заменить протеолитические бактерии, вызывающие диарею, и рекомендовал введение бифидобактерий новорожденным, страдающим от этого синдрома. Термин «пробиотики» впервые был введен в 1965 г. Лилли и Стиллуэллом; в противоположность антибиотикам, пробиотики были описаны как микробные факторы, стимулирующие рост других микроорганизмов.
В соответствии с определением рабочей группы ВОЗ к пробиотикам относят живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина. Они подразделяются по количеству входящих в состав препарата культур на монокомпонентные (Бифидумбактерин, Энтерол, Бактисубтил и т. д.) и поликомпонентные (Линекс), а также по свойству пробиотической культуры на самоэлиминирующиеся антагонисты (Энтерол, Бактисубтил) и на бифидосодержащие, лактосодержащие и колисодержащие. Так, например, препарат Линекс относится к поликомпонентным бифидо- и лактосодержащим пробиотикам, так как содержит три пробиотических микроорганизма Bifidobacterium infantis, Lactobacillus acidophilus и Enterococcus faecium. Входящие в его состав лактобактерии и энтерококк преимущественно колонизируют тонкую кишку, а бифидобактерии — толстую, поэтому пробиотические культуры наиболее физиологично поддерживают колонизационную резистентность и способствуют выполнению функций индигенной кишечной микрофлоры.
К доказанным эффектам пробиотиков относят [1]:
-
активацию локальных макрофагов для увеличения презентации антигенов B лимфоцитам и увеличения производства секреторного иммуноглобулина А (IgA) местно и системно;
-
модулирование цитокиновых профилей;
-
переваривание пищи и конкуренцию за питательные вещества с патогенами;
-
изменение локальной pH для создания невыгодного местного окружающего пространства для развития патогенов;
-
производство бактериоцинов для подавления патогенов;
-
устранение супероксидных радикалов;
-
стимуляцию продукции эпителиального муцина;
-
усиление барьерной функции кишечника;
-
конкуренцию с патогенами за адгезию.
-
модификацию патогенных токсинов.
Помимо пробиотиков, средства коррекции микробиоты включают также пребиотики и синбиотики. Пребиотики представляют собой стабилизаторы среды обитания и стимуляторы роста нормальной микрофлоры. В эту группу входят препараты, относящиеся к различным фармакотерапевтическим группам, но обладающие общим свойством — способностью стимулировать рост и развитие нормальной микрофлоры кишечника. К пребиотикам относят лактулозу, глюкозу, протеины, камедь, аминокислоты, витамины и минералы, инулин, каолин, пищевые волокна, дрожжи [2]. Лактулоза — синтетический дисахарид, не встречающийся в природе, в котором каждая молекула галактозы связана b-1,4-связью с молекулой фруктозы. Лактулоза попадает в толстый кишечник в неизмененном виде (лишь около 0,25–2,0% всасывается в неизмененном виде в тонкой кишке) и служит питательным субстратом для сахаролитических бактерий. В процессе бактериального разложения лактулозы на короткоцепочечные жирные кислоты (молочная, уксусная, пропионовая, масляная) снижается рН содержимого толстой кишки. За счет этого же повышается осмотическое давление, ведущее к задержке жидкости в просвете кишки и усилению ее перистальтики. Лактулоза способствует нормализации стула у пациентов с хроническими запорами и может назначаться длительно. Одним из наиболее перспективных пребиотических веществ является инулин (полисахарид растительного происхождения, который содержится в топинамбуре), который избирательно стимулирует рост бифидобактерий и лактобацилл, подавляет рост условно-патогенных микроорганизмов, а также способствует нормализации моторной функции кишечника. Его комбинация с пробиотическими культурами — основа для создания эффективных синбиотических средств (например, в состав Линексбио включен инулин с олигофруктозой, а также с пробиотическими бактериями L. acidophilus (LA-5) и Bifidobacterium animalis subsp. lactis (BB-12)).
Микробные ассоциации желудочно-кишечного тракта характеризуются сложной иерархической структурой, различными межвидовыми отношениями и многоступенчатыми метаболическими процессами, конечным результатом которых являются биологически активные соединения — микробные метаболиты. Наиболее точными методами оценки состояния микробиоты и ее функциональной активности являются аспирация содержимого и посев биоптатов из слизистой тонкой и толстой кишки на питательные среды; неинвазивный дыхательный тест с лактулозой, исследование уровня летучих жирных кислот в кале, газожидкостная хроматография малодоступны на сегодняшний день в широкой клинической практике, в связи с чем назначение средств, способствующих нормализации микробиоценоза, определяется прежде всего клинической ситуацией [3].
К наиболее доказанным клиническим рекомендациям по использованию пробиотиков относятся следующие [4]:
-
Пробиотики эффективны для профилактики антибиотик-ассоциированной диареи (уровень доказательности A). Наиболее целесообразно использование Saccharomyces boulardii и L. rhamnosus GG.
-
В соответствии с результатами крупномасштабного Кокрановского обзора и метаанализа, включивших исследования диареи вирусной этиологии и диареи путешественников, терапия пробиотиками снижает как продолжительность (по меньшей мере, на 30 часов), так и тяжесть симптомов диареи (уровень доказательности А).
-
В соответствии с проведенными до настоящего времени исследованиями, у пациентов с синдромом раздраженного кишечника терапия пробиотиками снижает выраженность болевого синдрома и вздутие живота (уровень доказательности B).
-
У детей из группы риска возникновения атопии пробиотики могут предотвращать развитие атопического дерматита (уровень доказательности В), а также существуют предварительные доказательства эффективности купирования симптомов атопического дерматита при использовании пробиотиков.
Механизм действия пробиотиков на молекулярном уровне активно изучается [5]. Известно, что практически все микроорганизмы взаимодействуют с клетками макроорганизма через так называемые Toll-подобные рецепторы (TLR) — семейство мембранных гликопротеинов, присутствующих на макрофагах, нейтрофилах, дендритных клетках, эпителиоцитах (рис. 1).
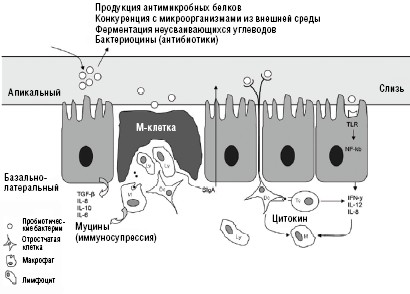
Сигналы патогенных микробов и представителей индигенной флоры воспринимаются этими рецепторами по-разному. При реакции TLR на соответствующий структурный паттерн разрывается его комплекс с ингибитором (Tollip), и TLR передает стимулирующий импульс на белок NFkB, вследствие чего последний транспортируется в ядро клетки. Активация NFkB приводит к переключению дифференцировки Th0-лимфоцитов на Thl-путь и стимуляции выработки провоспалительных цитокинов. Назначение пробиотиков ингибирует активацию NFkB за счет предупреждения его ингибитора lkВ-альфа. По-разному воспринимается и микробная ДНК патогенов и комменсалов. Олигонуклеотиды, в которых содержатся неметилированные динуклеотиды, что свойственно патогенной и условно-патогенной микрофлоре, улавливаются TLR с последующей стимуляцией воспалительного ответа.
Эукариоидная ДНК и метилированные динуклеотиды, свойственные индигенной флоре, не воспринимаются TLR и не активируют иммунный ответ. Очевидно, что разные штаммы пробиотиков способны по-разному восприниматься МALT-системой, более того, восприятие каждого из препаратов может быть индивидуально. Тем не менее, большинство проведенных клинических и экспериментальных исследований свидетельствуют о том, что пробиотические штаммы лактобактерий (LGG, L. acidophylus), E. faecium, S. thermophylus воспринимаются TLR и стимулируют воспалительный ответ, усиливая выработку Th1 и IL-1, INF-альфа. Они стимулируют фагоцитарную активность нейтрофилов и выработку SIgА. В то же время бифидобактерии оказывают стимулирующее воздействие на Th-reg и, соответственно, выработку TGF-бета, IL-10, способствуя формированию иммунологической толерантности. Этот процесс сопровождается снижением синтеза IgE и усилением синтеза SIgA. Наиболее активно повышают уровень IL-10 В. longum, B. bifidum, B. infantis. Пробиотики, в состав которых входят симбионтные штаммы бактерий, аэробы и анаэробы, вероятно, могут оказывать более многоплановое и мощное иммуномодулирующее действие, чем монокомпонентные препараты.
Иммунорегулирующее действие пробиотиков расширяет возможности их использования и раскрывает широкие перспективы для применения в разных клинических ситуациях [6]. Так, в новом международном согласительном документе по применению про- и пребиотиков (htpp://www.worldgastroenterology.org) в число нозологических форм, при которых показан прием препаратов этой группы, включены воспалительные заболевания кишечника, а также обсуждается эффективность пробиотической терапии при аутоиммунных заболеваниях.
Не менее интересным представляется и рассмотрение роли микробиоты кишечника в регуляции обменных процессов, а также роль нарушения индигенной микрофлоры кишечника в развитии нарушения липидов (ожирения, гипер- и дислипидемии) и углеводного обмена (сахарный диабет, нарушение толерантности к глюкозе) (рис. 2) [7].
![Рис. 2. Участие кишечного микробиоценоза в формировании обменных нарушений [8] Рис. 2. Участие кишечного микробиоценоза в формировании обменных нарушений [8]](http://www.osp.ru/data/2010/03/16/1227849851/36.jpg)
Известно, что главным физиологическим механизмом холестеринового гомеостаза является экскреция желчных кислот с желчью в процессе их энтерогепатической циркуляции по принципу «обратной связи», регламентирующему внутрипеченочный синтез стероида и его метаболизм в желчные кислоты. При синдроме избыточного бактериального роста микробиота толстого кишечника при помощи ферментативного аппарата бактерий нарушает метаболизм желчных кислот в цикле их энтерогепатической циркуляции, приводя в итоге к дислипопротеидемии. Основным органом-мишенью при этом становится печень.
Установлено, что при дислипидемии (облитерирующем атеросклерозе, жировой инфильтрации печени, метаболическом синдроме и др.) происходят выраженные дисбиотические изменения кишечника с понижением общего уровня летучих жирных кислот и повышением анаэробного индекса, характерных для угнетения резидентной микрофлоры кишечника. Таким образом, создается «порочный круг»: нарушение микроэкологии кишечника — нарушение энтерогепатической циркуляции желчных кислот — нарушение функции печени — нарушение обмена липидов — нарушение структуры печени (жировая инфильтрация, фиброз) — нарушение обмена липидов — поддержание (усугубление) нарушенного кишечного дисбиоза [9]. Эти данные позволяют экспертам Международной организации гастроэнтерологов рассматривать в качестве возможных показаний к назначению пробиотиков и пребиотиков заболевания сердечно-сосудистой системы, а также обмена веществ (ожирение, сахарный диабет).
Таким образом, с течением времени пробиотики не только не утратили своей актуальности, но и демонстрируют в клинической практике свои новые свойства, позволяющие расширить горизонты профилактики, эффективной и безопасной терапии заболеваний, нормализации деятельности иммунной системы и обмена веществ.
Литература
-
Всемирная Гастроэнтерологическая ассоциация. Практические рекомендации. Пробиотики и пребиотики. Май 2008. http://www.worldgastroenterology.org/assets/downloads/ru/pdf/guidelines/19_probiotics_prebiotics_ru.pdf.
-
Шендеров Б. А. Медицинская микробная экология и функциональное питание. Том I: Микрофлора человека и животных и ее функции. М.: Издательство ГРАНТЪ, 1998. 288 с.
-
Jonkers D., Stockbrugger R. Review article: Probiotics in gastrointestinal and liver diseases. 2007 Dec;26 Suppl. 2: 133–48.
-
Kligler B., CohrssAliment Pharmacol Theren A. Probiotics. Am Fam Physician. 2008; 78: 1073–1078.
-
Borivant M., StroberW. The mechanism of action of probiotics. Curr Opin Gastroenterol. 2007 Nov; 23 (6): 679–92.
-
Gill H., Prasad J. Probiotics, immunomodulation, and health benefits. Adv Exp Med Biol. 2008; 606: 423–54.
-
Eamonn P. Culligan, Colin Hill, Roy D. Sleator. Probiotics and gastrointestinal disease: successes, problems and future prospects Gut Pathogens 2009, 1:19 doi: 10.1186/1757–4749–1-19.
-
Huey-Shi Lye, Chiu-Yin Kuan, Joo-Ann Ewe, Wai-Yee Fung and Min-Tze Liong. The Improvement of Hypertension by Probiotics: Effects on Cholesterol, Diabetes, Renin, and Phytoestrogens *Int. J. Mol. Sci. 2009, 10, 3755–3775; doi:10.3390/ijms10093755.
-
Vitali B., Ndagijimana M., Cruciani F., Carnevali P. Impact of a synbiotic food on the gut microbial ecology and metabolic profiles BMC Microbiology 2010, 10:4 doi: 10.1186/1471–2180–10–4.
М. А. Ливзан, доктор медицинских наук, профессор
ГОУ ВПО «Омская государственная медицинская академия Росздрава», Омск
Контактная информация об авторе для переписки: mlivzan@yandex.ru
Купить номер с этой статьей в pdf









